如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
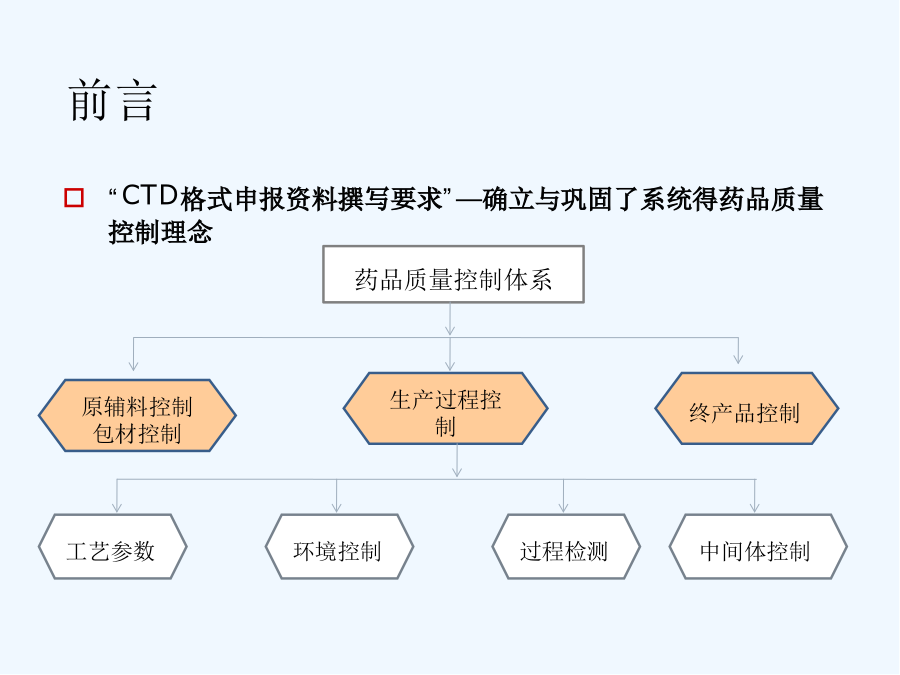
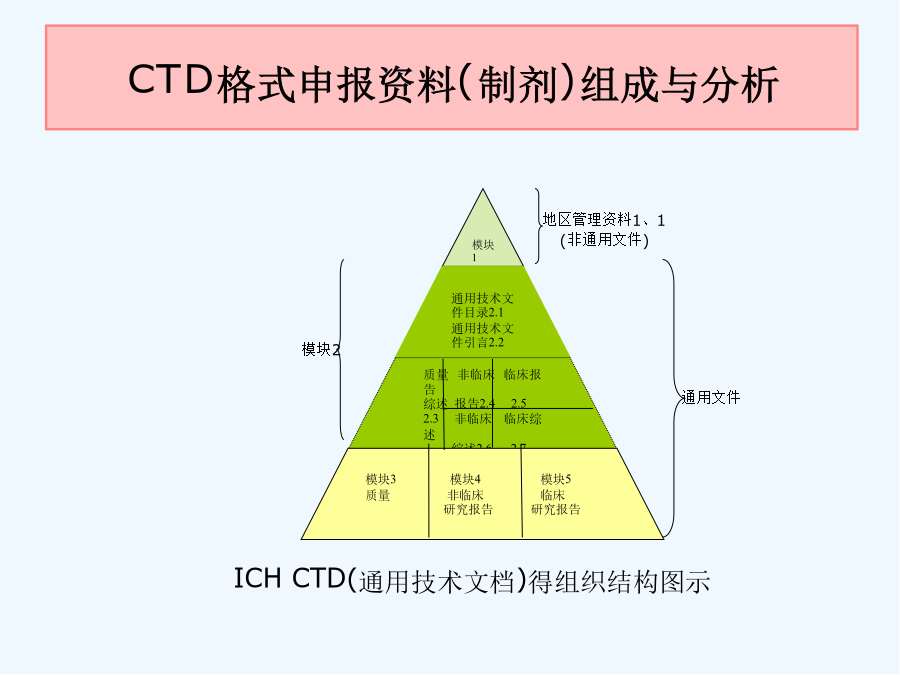
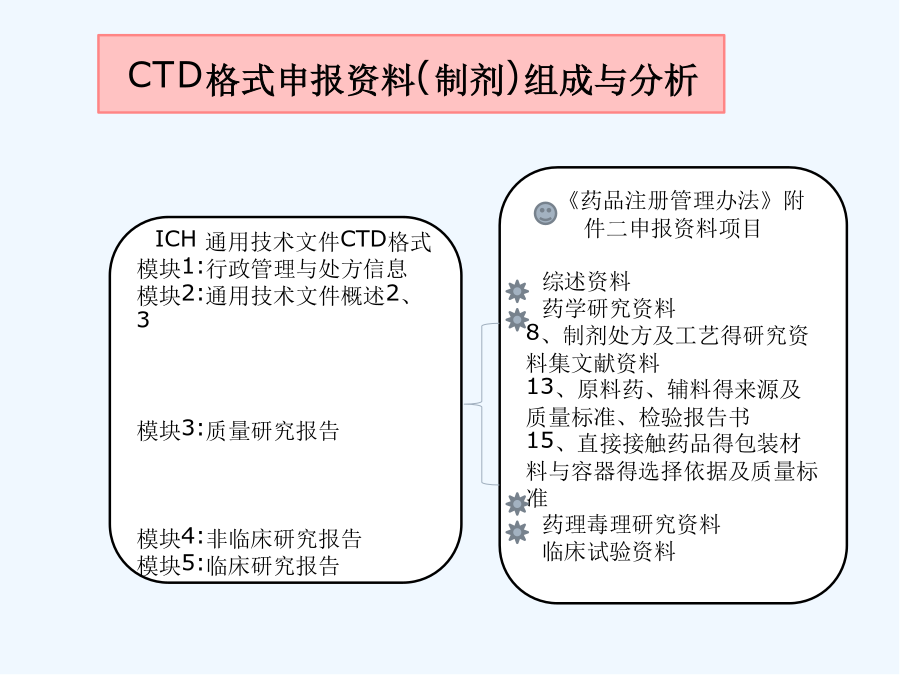
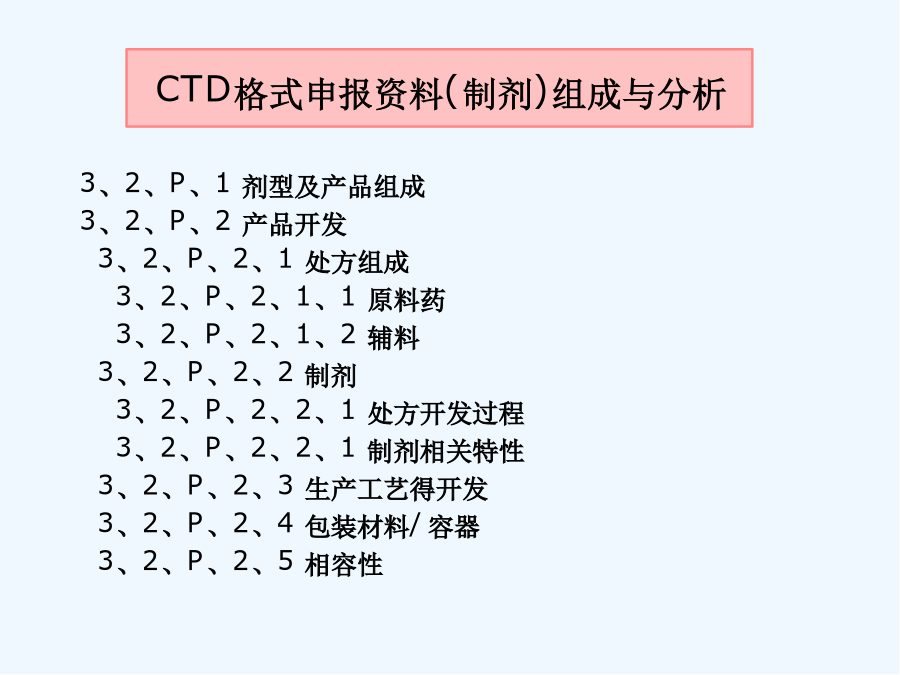
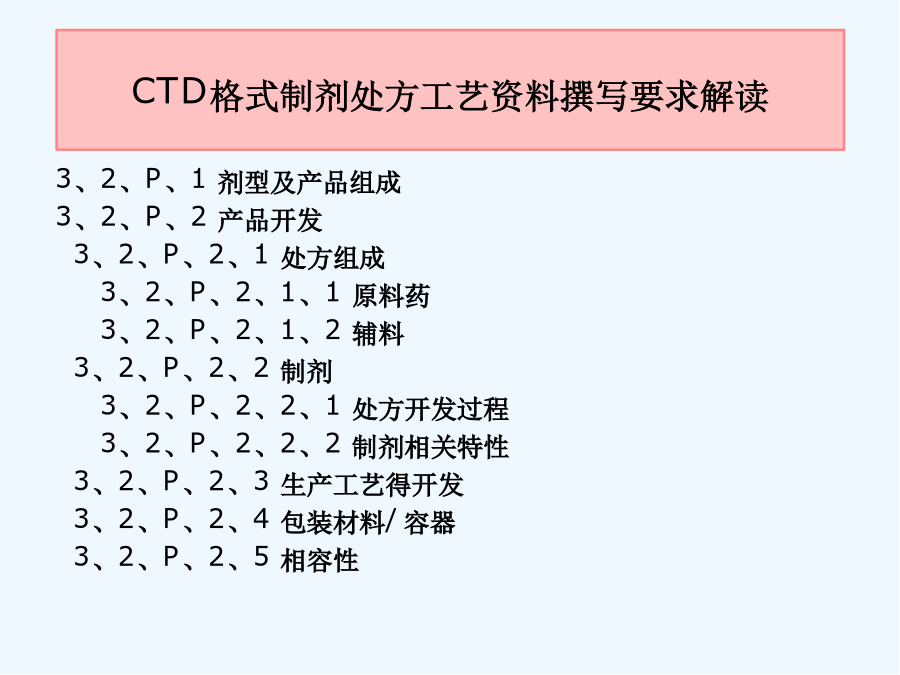
第四讲制剂处方工艺资料要求解读前言前言模块1ICH通用技术文件CTD格式模块1:行政管理与处方信息模块2:通用技术文件概述2、3模块3:质量研究报告模块4:非临床研究报告模块5:临床研究报告3、2、P、3生产3、2、P、3、1生产商3、2、P、3、2批处方3、2、P、3、3生产工艺与工艺控制(1)工艺流程图(2)工艺描述(3)主要得生产设备(4)拟定得大生产规模3、2、P、3、4关键步骤与中间体得控制3、2、P、3、5工艺验证得评价3、2、P、4原辅料得控制与按附件二整理申报资料相比:格式不同,技术要求一致申报资料更体现研究逻辑性研究脉络更清晰更加强调质量控制体系通过处方与生产工艺开发,对产品关键质量特性进行研究与确认,对关键工艺环节进行研究,建立关键工艺参数控制大生产条件下,工艺就是否能够稳定、持续生产出质量符合要求得药品通过药品研究质量控制体系证明建立系统、有效得药品生产质量控制体系3、2、P、1剂型及产品组成3、2、P、2产品开发3、2、P、2、1处方组成3、2、P、2、1、1原料药3、2、P、2、1、2辅料3、2、P、2、2制剂3、2、P、2、2、1处方开发过程3、2、P、2、2、2制剂相关特性3、2、P、2、3生产工艺得开发3、2、P、2、4包装材料/容器3、2、P、2、5相容性12应包含为了确定剂型、处方、生产工艺、直接接触药品得包装容器而开展得研究工作。应确定并描述可影响批次可重复性、产品性能与药品质量得处方与工艺特性(关键工艺、关键参数)。特定研究或已发表文献得支持性数据与结果可列入此章节内或附于此章节。其她支持性数据可参考申报材料相关非临床或临床章节。3、2、P、2、1、1原料药说明原料与辅料得相容性--根据药物性质、拟考察得制备工艺,选择可靠得分析方法,有针对性进行研究。相容性仿制:新药:原料药分别与每种辅料混合物理不相容性:显微镜,热分析,光谱法化学不相容性:pH值,HPLC,GC法制剂性能相关性:---剂型、处方---工艺可行性对湿不稳定,干法制粒---分析方法3、2、P、2、1处方组成3、2、P、2、1、1原料药分析与生产及制剂性能相关得关键理化特性--晶型--溶解性不同pH、溶剂;生物药剂学分类(BCS)--粒度分布粒度与制剂工艺/溶出或释放行为/生物利用度,进行批汇总分析--吸湿性3、2、P、2、1处方组成3、2、P、2、1、2辅料说明辅料种类与用量选择得依据,分析辅料用量就是否在常规用量范围内,就是否适合所用给药途径辅料选择:√符合药用要求,注射剂辅料应符合注射要求√主药与辅料、辅料间不发生不良相互作用√根据制剂需要选择必要得辅料结合辅料在处方中得作用分析辅料得哪些性质会影响制剂特性3、2、P、2、2制剂研究3、2、P、2、2、1处方开发过程参照相关技术指导原则,提供处方研究开发过程与确定依据:文献信息(如对照药品得处方信息)研究信息(包括处方设计,处方筛选与优化、处方确定等研究内容)与对照品得质量特性对比研究结果重点:小试-中试-放大阶段处方得主要变更、原因以及支持变化得验证研究。3、2、P、2、2制剂研究3、2、P、2、2、1处方开发过程如果存在过量投料,应说明并分析必要性与合理性原料与辅料原则:慎重,尽量优化处方、工艺、设备、验证。提供信息:超过得量;过量得理由(补偿生产损失);对超过量得合理解释。3、2、P、2、2制剂研究3、2、P、2、2、1处方开发过程关注—处方设计思路及预期达到目标--处方筛选、优化及处方确定,与对照品进行质量对比研究√基于前期对药物/辅料参考有针对性设计,系统设计各种处方进行筛选研究√制剂基本性能评价/稳定性评价---考察指标:影响质量与稳定性得关键项目,关注制剂得个性化指标考察√确定得影响制剂质量得关键因素。3、2、P、2、2制剂研究3、2、P、2、2、1处方开发过程关注—说明小试、中试放大/处方转移等研发阶段处方变化情况,重点讨论临床试验用处方与3、2、P、1中处方之间得差异,进行支持变化得验证研究。关注对于生产中存在过量投料得,需说明其合理性与必要性,并提供支持性资料。一般需经过重复批次验证。3、2、P、2、2制剂研究3、2、P、2、2、2制剂相关特性--与制剂性能相关得理化性质,如溶出度/释放度,有关物质、粒径分布、晶型等--提供与对照品质量研究特性对比研究结果有关物质溶出行为不同溶出条件下比较—f2相似因子样品--临床试验样品--稳定性试验中试样品3、2、P、2、3生产工艺得开发简述生产工艺得选择与优化过程