如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
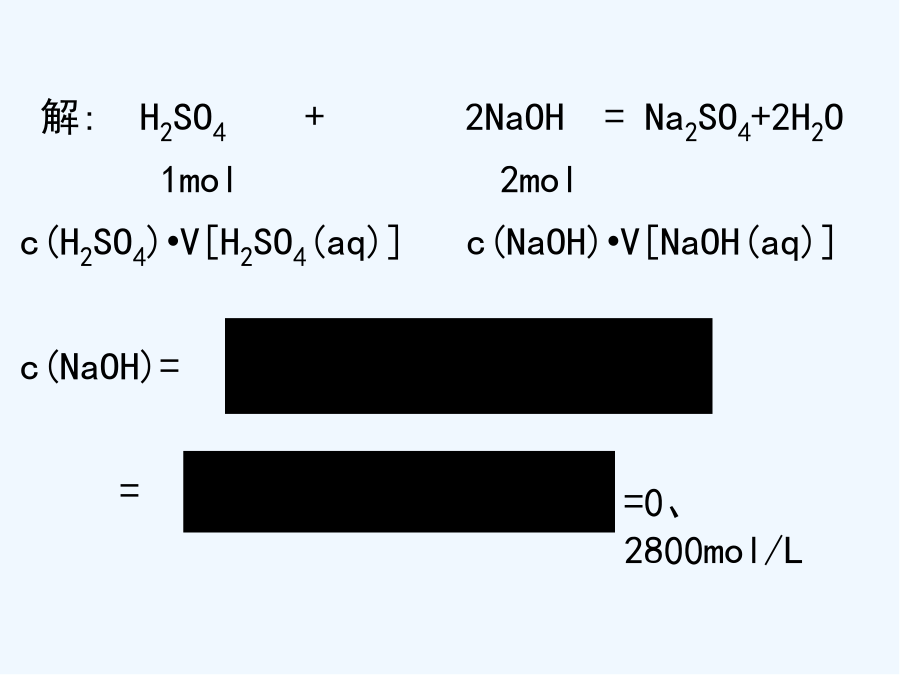
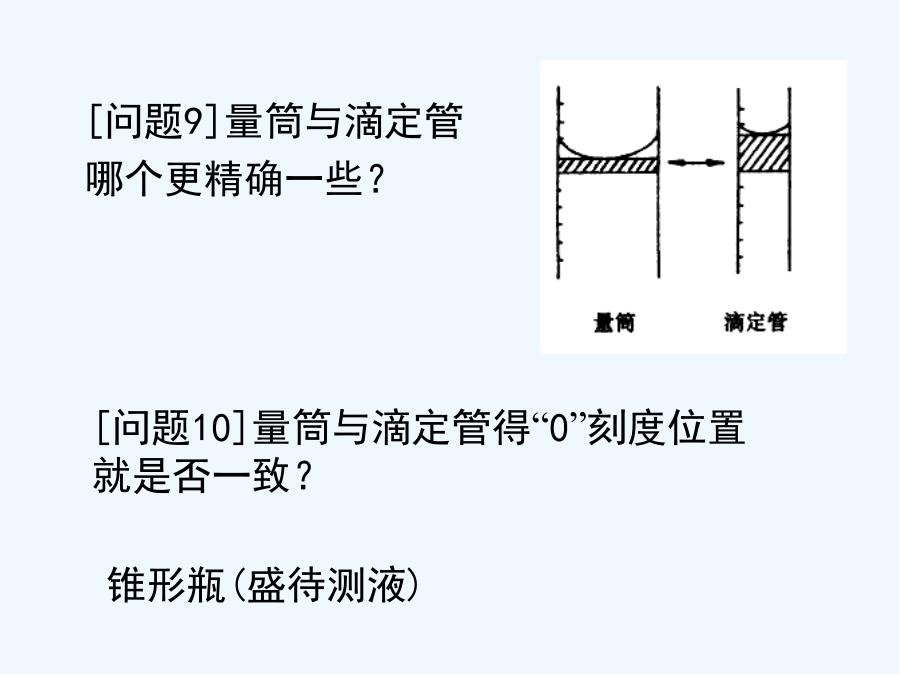
滴定的完整课件[问题1]用什么方法可以比较精确地测得这瓶未知浓度NaOH溶液得浓度?一、酸碱中与反应原理[课堂练习]用0、1100mol/L得HCl溶液滴定23、00mL未知浓度得NaOH溶液,滴定完成时,用去HCl溶液29、00mL。通过中与滴定测得NaOH溶液得物质得量浓度就是多少?解:HCl+NaOH=NaCl+H2O1mol1molc(HCl)•V[HCl(aq)]c(NaOH)•V[NaOH(aq)]c(NaOH)==解:H2SO4+2NaOH=Na2SO4+2H2O1mol2molc(H2SO4)•V[H2SO4(aq)]c(NaOH)•V[NaOH(aq)]c(NaOH)==[问题5]运用这种方法得关键问题就是什么?4、关键:5、仪器[问题10]量筒与滴定管得“0”刻度位置就是否一致?[问题11]用什么试剂可指示酸碱恰好完全反应?大家有疑问的,可以询问和交流酸碱指示剂:酚酞[问题13]酸碱中与滴定选用酚酞作指示剂,但其滴定终点得变色点并不就是pH=7,这样对中与滴定终点得判断有没有影响?[练习1]在20、00mL0、1000mol/L得盐酸中,逐滴滴入0、1000mol/LNaOH溶液40、00mL。⑴判断下列情况下溶液得pH。①未滴NaOH溶液时HCl得pH;②滴加NaOH溶液到完全反应相差一滴(一滴溶液得体积就是0、04mL),这时溶液得pH;③完全反应后再多加一滴NaOH溶液时得pH;④逐滴加入NaOH溶液40、00mL时溶液得pH;⑵跟完全反应所需NaOH溶液相差一滴(或多加一滴),对计算盐酸得浓度有没有影响?(通过计算说明。)ph、swf[结论]⑴在滴定终点前后,溶液得pH发生突跃。⑵酚酞得变色点落在溶液pH得突跃范围内。⑶按pH突跃范围内得体积计算,结果就是可以达到足够得准确度得。4、演示酸碱中与滴定得过程:(用已知物质得量浓度得盐酸滴定未知物质得量浓度得氢氧化钠)⑴滴定管、(移液管)、锥形瓶用水洗干净标准:内壁不挂水珠。⑵滴定管检漏,活塞灵否⑶装液读数时要注意:①滴定管要直立;②装液或放液后,需等1-2分钟才能观察液面高度;③读数时,视线应在弯月面下沿最低点,而且与液面水平,防止俯视或仰视;④必须准确到0、1mL,并估计到0、01mL。⑷用滴定管(或移液管)移取定量待测液注入锥形瓶,滴加2-3滴指示剂,振荡混匀。注意:不能用待测液洗涤滴定管。⑸进行滴定⑹滴定到指示剂颜色变化,并不立即褪去,即为滴定终点⑺计算。HCl+NaOH=NaCl+H2O[练习2]在酸碱中与滴定中,甲基橙与酚酞都可用作滴定终点得指示剂。已知它们得变色范围如下表:指示剂pH变色范围酸色碱色甲基橙3、14、4红色(pH<3、1)黄色(pH>4、4)酚酞8、210、0无色(pH<8、2)红色(pH>10、0)⑴为尽可能减小实验误差,请选用合适得指示剂。①强酸与弱碱中与滴定--②强碱与弱酸中与滴定--③强酸与强碱中与滴定--⑵强酸滴定强碱,可采用:甲基橙酚酞强碱滴定强酸,可采用:甲基橙酚酞请指出达到终点时指示剂得颜色变化。(半分钟内不变色)三、误差原因分析(标准酸滴定未知碱)HnA+nNaOH=nNaA+nH2O1molnmolC酸V酸C碱V碱C碱=