如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
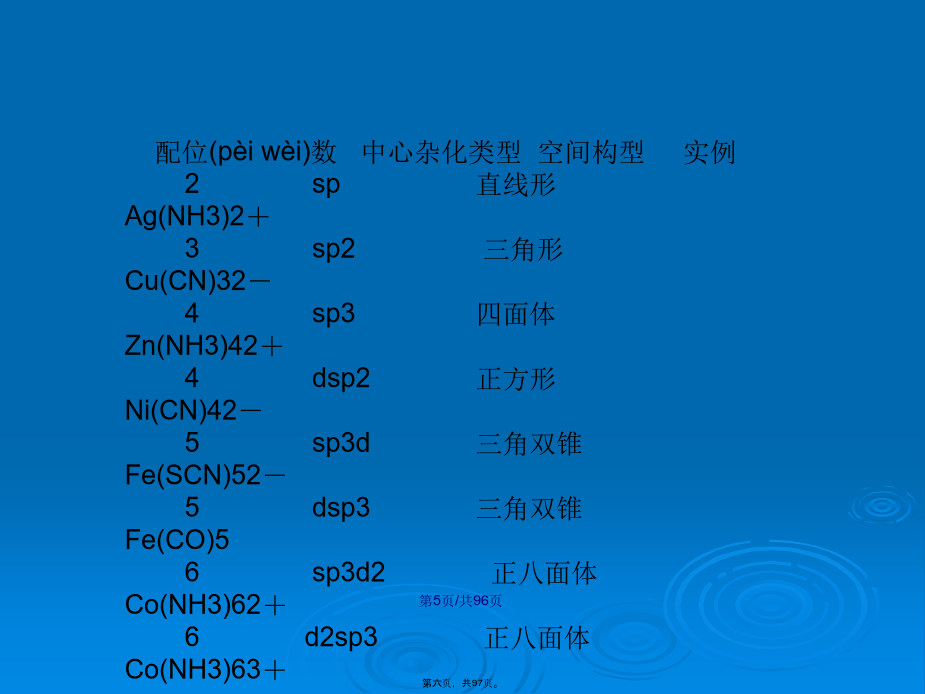
配合(pèihé)物的化学键理论第三章配合(pèihé)物的化学键理论§3-1配合(pèihé)物的价键理论(Valencebondtheory)1.理论要点和配合物的本质形成体(M)有空轨道,配位体(L)有孤对电子或π电子,形成配位键ML;形成体(中心离子)采用杂化轨道成键;配位单元的构型与中心空轨道的杂化类型有关(yǒuguān);可以形成反馈π键──由金属原子提供电子对与配体空的反键π轨道形成的配位键。=(B.M)玻尔磁子其中n为配合物中的成单电子数,为配合物的磁矩。配位(pèiwèi)数中心杂化类型空间构型实例2sp直线形Ag(NH3)2+3sp2三角形Cu(CN)32-4sp3四面体Zn(NH3)42+4dsp2正方形Ni(CN)42-5sp3d三角双锥Fe(SCN)52-5dsp3三角双锥Fe(CO)56sp3d2正八面体Co(NH3)62+6d2sp3正八面体Co(NH3)63+中心(zhōngxīn)离子Ni2+的结构[Ni(CN)4]2–的结构(jiégòu)[FeF6]3-或[Fe(H2O)6]3+外轨型配合物:配位原子的电负性很大,如卤素、氧等,不易给出孤电子对,使中心离子的结构(jiégòu)不发生变化,仅用外层的空轨道ns、np和nd进行杂化生成能量相同,数目相等的杂化轨道与配体结合。内轨配合(pèihé)物:配位原子的电负性较小,如氰基(CN-,以C配位),氮(-NO2,以N配位),较易给出孤电子对,对中心离子的影响较大,使电子层结构发生变化,(n-1)d轨道上的成单电子被强行配位(需要的能量叫“成对能”,P)腾出内层能量较低的d轨道接受配位体的孤电子对,形成内轨型配合(pèihé)物。根据实验测得的有效磁矩,判断下列各种离子(lízǐ)分别有多少个未成对电子?哪个是外轨?哪个是内轨?配合物中的d-pπ配键(反馈π键)过渡(guòdù)金属与羰基、氰、链烯烃、环烯烃等含有π电子配体形成的配合物都含有d-pπ配键(反馈键)。例讨论Ni(CO)4的成键情况解:Ni采取sp3杂化,CO中C上的孤电子对向Ni的sp3杂化空轨道(guǐdào)配位,形成σ配键。实验结果表明,Ni(CO)4较稳定,这和配体与中心之间只有σ配键不符,进一步实验和理论计算都证明,中心原子与配体之间肯定还有其它成键作用。(2)氰配合物氰(CN-)配位能力很强,与过渡金属形成的配合物都很稳定,除了C原子给电子能力较强外,氰能与过渡金属形成d-pπ配键也是一个重要因素。CN-与CO相似,既有可配位的孤电子对,又有与d轨道对称性一致(yīzhì)的π*轨道可接受d电子的配位。与羰基配合物成键过程相似,CN-配体中C上的孤电子对向金属的杂化空轨道配位,形成σ配键,金属的d电子向CN-π*轨道配位,形成d-pπ配键。(3)烯烃配合(pèihé)物1827年,Zeise合成了K[PtCl3(C2H4)]·H2O,这是第一个有机金属化合物,但其结构直到120多年后才确定。乙烯的成键π电子向铂的杂化轨道配位,按成键的对称性应为σ配键;金属d轨道的电子向乙烯的π*轨道配位,形成d-pπ配键。对配合(pèihé)物构型的解释外轨型配合物是中心离子的电子结构不受配体影响,保持其自由离子的结构,给予体电子排布在外层轨道(guǐdào),中心离子和配体借静电引力结合在一起。内轨型配合物是中心离子的内层d电子重新排布空出部分轨道(guǐdào)参与成键,中心离子和配体借较强的共价键结合在一起。3.它不能解释(jiěshì)化合物的电子光谱跃迁问题,因为没有提到反键轨道;在此过程中,自由离子Cu2+要由3d激发一个电子到4p需要的激发能为1422.6kJ·mol-1,看不出这么大的能量从何而来。根据这个结构,可以推测Cu2+的配合物应当(yīngdāng)很容易地失去未配对的4p电子而迅速氧化为Cu3+,但事实并非如此。过渡元素具有强烈的形成配合物的趋向,原因:1.过渡元素有能量(néngliàng)相近的属同一个能级组的(n-1)d、ns、np共九条价电子轨道。按照价键理论,这些能量(néngliàng)相近的轨道可以通过不同形式的杂化,形成成键能力较强的杂化轨道,以接受配体提供的电子对,形成多种形式的配合物。2.过渡金属离子是很好的配合物的中心形成体。过渡金属离子的有效核电荷大;电子构型为9~17型,这种电子构型的极化能力(nénglì)和变形性都较强,因而过渡金属离子可以和配体产生很强的结合力。除中心离子与配体之间的静电场吸引外,着重考虑配体对中心离子的外层d轨道(guǐdào)中电子的静电排斥作用。d轨道示意图晶体场理论要点:①把配体视为点电荷或偶极子(不考虑其结构