如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
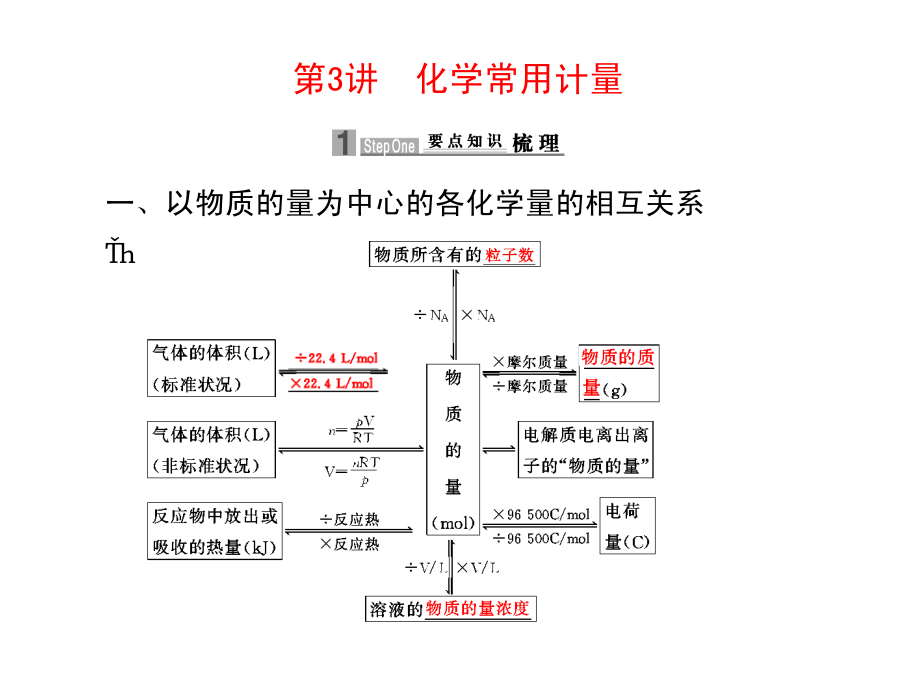
第3讲化学常用计量二、物质的量浓度与w、S的相互关系1.物质的量浓度与溶质质量分数的换算c=(ρ的单位为g/cm3)解析本题由n==c·V进行计算:B项,=1∶1,=14∶1;C项,由n=c·V,V未知,故n无法求知。以物质的量为中心的计算需注意的问题1.“一个中心”:必须以物质的量为中心。2.“两个前提”:在应用Vm=22.4L·mol-1时,一定要有“标准状况”和“气体状态”两个前提条件(混合气体也适用)。3.“三个关系”:(1)直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系;(2)摩尔质量与相对分子质量间的关系;(3)“强、弱、非”电解质与溶质粒子(分子或离子)数之间的关系。4.“七个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关)。解析由于产生cmolNH3,则必定有NHcmol,使SO完全沉淀需Ba2+bmol,因此SO有bmol。根据电荷守恒:2c(SO)=c(NH)+3c(Al3+),则3c(Al3+)=(2×)mol/Lc(Al3+)=mol/LC.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NAD.1L浓度为1mol/L的Na2CO3溶液中含有NA个CO有关阿伏加德罗常数的应用问题,实质上是以物质的量为中心的各物理量间的换算,需要特别注意的是准确掌握有关概念的内涵。主要有:1.状态问题,如标准状况下SO3为固态,戊烷为液态。标准状况下的气体适用气体摩尔体积(22.4L/mol),相同状况下的气体适用阿伏加德罗定律。2.特殊物质的摩尔质量,如D2O、18O2等。3.物质分子中的原子个数,如O3、白磷、稀有气体等。4.某些物质中的化学键,如SiO2、P4、CO2等。5.物质中某些离子或原子团发生水解,如Na2CO3中的CO、AlCl3中的Al3+。6.常见可逆反应,如2NO2N2O4,弱电解质不完全电离等。7.应用22.4L/mol时,物质是否为气体,气体是否处于标准状况。8.某些反应中电子转移的数目,如:NA为阿伏加德罗常数,下列说法正确的是()A.10g甲烷所含有的电子数目为10NAB.常温常压下,4g氦气所含有的中子数目为4NAC.标准状况下,22.4L单质溴所含有的原子数目为2NAD.电解食盐水若产生2g氢气,则转移的电子数目为2NA4g氦气所含中子数目为2NA,B不正确;标准状况下,单质溴为液态,2.24L液态溴的物质的量远大于1mol,故C不正确;由2NaOH+Cl2↑+H2↑知产生2gH2即1molH2时转移2NA个电子,D正确。(1)用w来表示该温度下氢氧化钠的溶解度(S)为。(2)用m、V表示溶液中溶质的物质的量浓度(c)为。(3)用w、d表示溶液中溶质的物质的量浓度(c)为。(4)用c、d表示溶液中溶质的质量分数为。答案(1)S=×100g(2)c=mol/L(3)c=0.25dwmol/L(4)w%=%②已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的物质的量浓度。应先运用n=V/22.4L/mol,求出溶质的物质的量,运用V=m/ρ求出溶液的体积。③计算溶液中的离子浓度,需要根据溶质的电离方程式,算出离子的物质的量。(2)溶液中溶质的质量分数与物质的量浓度之间的换算c=(c为溶质的物质的量浓度,单位是mol/L;ρ为溶液的密度,单位是g/cm3,w为溶质的质量分数,M为溶质的摩尔质量,单位是g/mol),按此公式换算即可。2.有关同溶质的溶液混合后溶液质量分数的计算规律(1)溶质相同的两溶液等质量混合时,混合溶液的质量分数为两溶液质量分数和的一半。(2)溶质相同的两溶液等体积混合时:①对于密度小于1g/cm3的溶液,如氨水、乙醇的水溶液,等体积混合时质量分数小于两溶液质量分数和的一半;②对于密度大于1g/cm3的溶液,如硫酸溶液、氯化钠溶液,等体积混合时质量分数大于两溶液质量分数和的一半。某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25℃时,将ag该晶体溶于bg水中恰好可形成VmL饱和溶液。下列关系正确的是()A.饱和溶液的物质的量浓度c=mol/LB.饱和溶液中溶质的质量分数w=%C.25℃时R的溶解度S=gD.饱和溶液的密度ρ=g/Lc(R)==B项,w=C项,,S=D项,,因此只有选项C正确。④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞塞紧,