如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
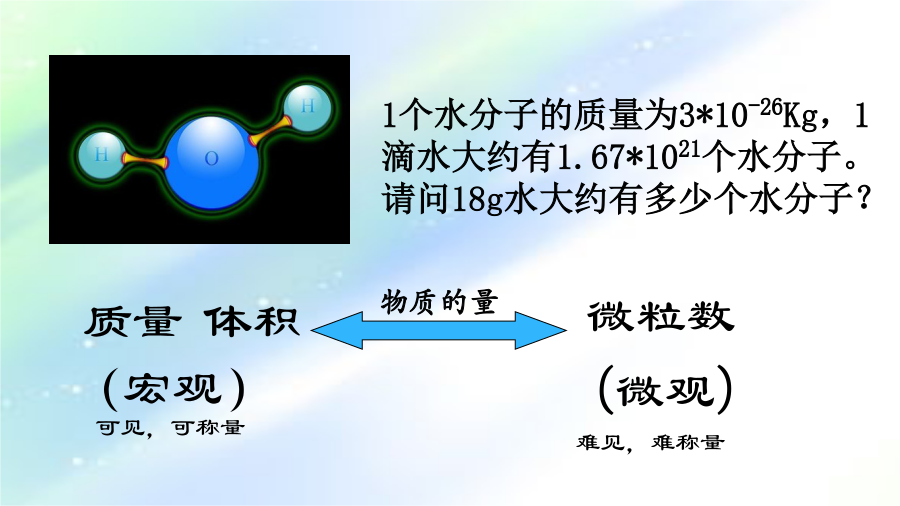
课题二化学计量在实验中的应用(1)--摩尔1个水分子的质量为3*10-26Kg,1滴水大约有1.67*1021个水分子。请问18g水大约有多少个水分子?⑵使用时要注意:①“物质的量”这四个字是一个整体,不能简化或添加任何字。②只适用于原子、分子、离子、质子、电子、中子等微观粒子或它们的特定组合。③使用“mol”为单位时,要指明粒子的种类,即用化学式表明物质的具体符号。物质的量是表示含有一定数目微观粒子的集合体。物质的量1、判断正误,并说明理由。A、1mol氢B、1molCO2C、1mol大米(×)多少支铅笔称“1打”谢谢课题二化学计量在实验中的应用(2)重点讲解:阿伏伽德罗常数,摩尔质量阿伏加德罗常数6.02×1023mol-1叫做阿伏加德罗常数,是个物理量,符号为NA。单位是mol-1;NA≈6.02×1023mol-1物质的量(n)、粒子数目(N)、阿伏加德罗常数(NA)的关系:在0.5molO2中含有的氧分子数目是多少?1个水分子的质量为3×10-26Kg,1滴水大约有1.67×1021个水分子。请问18g水大约有多少个水分子?2、摩尔质量:(1)100molH2O的质量是多少克?(2)0.1molOH-的质量是多少克?C+O2==CO2N7、下列说法正确的是()A、Na的摩尔质量为23gB、Na的摩尔质量为23C、Na的摩尔质量为23g/molD、Na的摩尔质量为23g×10-2kg/mol8、下列气体中所含分子数目最多的是A、1gH2B、10gCO2C、30gCl2D、17gNH3谢谢课题二化学计量在实验中的应用(3)--气体摩尔体积对于固体物质或液态物质来说,1mol不同物质的体积是不同的。1molH2O(l)决定物质体积大小的因素有三个:固体、液体的体积大小从微观角度分析,决定物质体积的三个因素2、气体摩尔体积1.“气体摩尔体积”不仅适用于单一气体,还适用于混合气体。1、在同温同压下,相同分子数的CO2、CO,其体积()。对于气体物质来说,在相同条件下,1mol不同气体的体积大约相同;而在标准状况时所占体积都约是22.4L。------这个结论也叫阿伏加德罗定律3、阿伏加德罗定律及其推论:谢谢课题二化学计量在实验中的应用(4)--物质的量浓度物质的量浓度质量如何配制1.00mol/L的NaCl溶液100mL①计算称量(托盘天平或量筒)③溶解(烧杯、玻璃棒)转移(容量瓶、玻璃棒)洗涤(烧杯、玻璃棒)定容(胶头滴管)摇匀装瓶(试剂瓶、贴签)①计算②称量③溶解④转移转移液体用蒸馏水洗涤小烧杯和玻璃棒2—3次,将洗涤液一并注入容量瓶。在容量瓶中继续加水至距刻度线1—2cm处,改用胶头滴管滴加至刻度(液体凹液面最低处与刻度线相切)。俯视⑦摇匀容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。谢谢课题二化学计量在实验中的应用(5)--误差分析如何配制1.00mol/L的NaCl溶液100mL①计算称量(托盘天平或量筒)③溶解(烧杯、玻璃棒)转移(容量瓶、玻璃棒)洗涤(烧杯、玻璃棒)定容(胶头滴管)摇匀装瓶(试剂瓶、贴签)C(B)=1)称量时左盘高,右盘低。6)未洗涤溶解用的玻璃棒和烧杯③定容引起的误差10)定容时液面低于刻度线14)原容量瓶洗净后未干燥练习例一、2mol/L的盐酸溶液200L和4mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。(混合液体积变化忽略不计)例二、2mol/L的盐酸200L和4mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?(混合液体积变化忽略不计)谢谢