如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
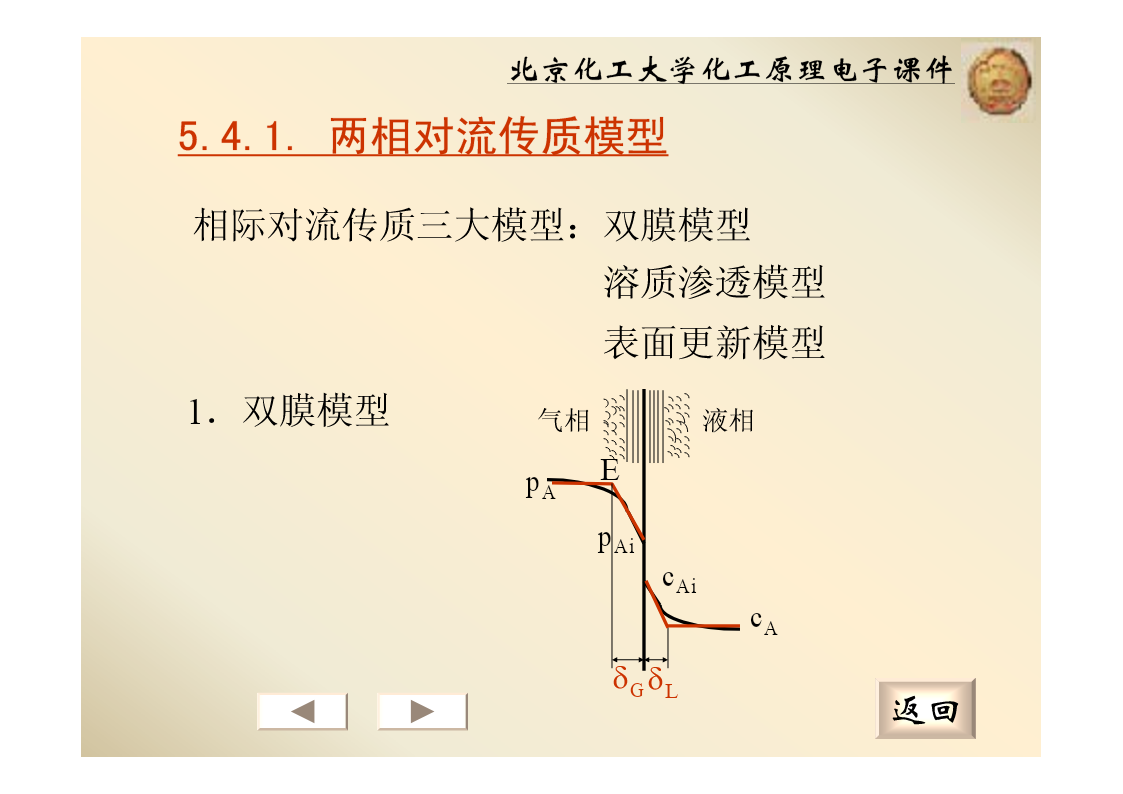
北京化工大学化工原理电子课件5.4.对流传质5.4.1.两相对流传质模型5.4.2.总传质速率方程5.4.3.传质阻力与传质速率的控制返回北京化工大学化工原理电子课件5.4.1.两相对流传质模型相际对流传质三大模型:双膜模型溶质渗透模型表面更新模型1.双膜模型气相液相EpApAicAicAδGδL返回北京化工大学化工原理电子课件2.双膜模型的基本论点(假设)(1)气液两相存在一个稳定的相界面,界面两侧存在稳定的气膜和液膜。膜内为层流,A以分子扩散方式通过气膜和液膜。(2)相界面处两相达平衡,无扩散阻力。(3)有效膜以外主体中,充分湍动,溶质主要以涡流扩散的形式传质。双膜模型也称为双膜阻力模型返回北京化工大学化工原理电子课件5.4.2.总传质速率方程1.吸收过程的总传质速率方程(1)用气相组成表示吸收推动力*NA=KG(pAG−pAL)*NA=Ky(y−y)KG——以气相分压差表示推动力的气相总传质系数,kmol/(m2·s·kPa);Ky——以气相摩尔分率差表示推动力的气相总传质系数,kmol/(m2·s);返回北京化工大学化工原理电子课件(2)用液相组成表示吸收推动力*NA=KL(cAG−cAL)*NA=Kx(x−x)——以液相浓度差表示推动力的液相总传KL质系数,kmol/m2·s·kmol/m3);Kx——以液相摩尔分率差表示推动力的液相总传质系数,kmol/(m2·s);(3)总传质系数与单相传质分系数之间的关系系统服从亨利定律或平衡关系在计算范围为直线返回北京化工大学化工原理电子课件*cAL=HpALNA=kL(cAi−cAL)根据双膜理论cAi=HpAi}*NA=HkL(pAi−pAL)1*NA=pAi−pALHkL1NA=pAG−pAikG⎛11⎞⎜⎟*⎜+⎟NA=pAG−pAL⎝HkLkG⎠返回北京化工大学化工原理电子课件1*NA=(pAG−pAL)⎛11⎞⎜+⎟⎝HkLkG⎠111=+KGHkLkGK=HK11HGL同理:=+KLkLkG11m用类似的方法得到=+KkkyyxmK=K111yx=+Kxkxmky返回北京化工大学化工原理电子课件(4)总传质系数之间的关系pKG=KycKL=KxKG=HKLmKy=Kx返回北京化工大学化工原理电子课件5.4.3.传质阻力与传质速率的控制注意.传质阻力1111=+KHkk:GLG与推动力一一对应�传质系数�传质阻力11H=+KLkLkG1m1=+Kykxky111=+Kxkxmky相间传质总阻力=液相(膜)阻力+气相(膜)阻力返回北京化工大学化工原理电子课件2.传质速率的控制步骤(1)气膜控制气膜控制:传质阻力主要集中在气相,此吸收过程为气相阻力控制(气膜控制)。气膜控制的特点:11≈KkGpGAG.H较大易溶气体*pAipAG−pAL≈pAG−pAip*IALN=k(p−p*)cc*AGAGALAAicAG返回北京化工大学化工原理电子课件提高传质速率的措施:提高气体流速;加强气相湍流程度。(2)液膜控制液膜控制:传质阻力主要集中在液相,此吸收过程为液相阻力控制(液膜控制)液膜控制的特点:p11AG.≈pKkAiLLp*H较小难溶气体ALc*−c≈c−c*AGALAiALcAG*ccNA=kL(cAG−cAL)ALAi返回北京化工大学化工原理电子课件提高传质速率的措施:提高液体流速;加强液相湍流程度。同理:11气膜控制:≈m小易溶气体Kyky**NA=ky(y−y)y−y≈y−yi11液膜控制:≈m大难溶气体Kxkx**x−x≈xi−xNA=kx(x−x)返回北京化工大学化工原理电子课件【例5-4】110kPa下操作的氨吸收塔,某截面上,含氨0.03摩尔分率的气体与氨浓度为1kmol/m3的氨水接-92触,已知气相传质系数kG=5×10kmol/(m·s·Pa),液-4相传质系数kL=1.5×10m/s,氨水的平衡关系可用亨利定律表示,H=7.3×10-4kmol/(m3·Pa),试计算:1)气液界面上的两相组成;2)以分压差和摩尔浓度差表示的总推动力、总传质系数、传质速率;3)以摩尔分率差表示总推动力的气相总传质系数;4)气膜与液膜阻力的相对大小。返回