如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
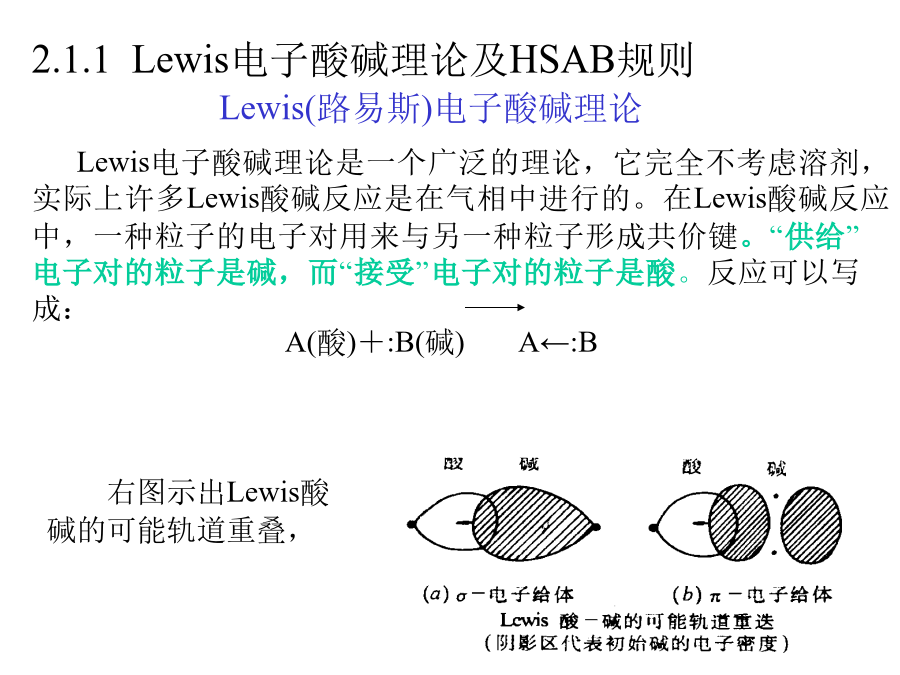
第二章酸碱和溶剂化学第二章酸碱和溶剂化学2.1.1Lewis电子酸碱理论及HSAB规则根据这种反应的实质,可以把路易斯酸称作电子接受体或亲电试剂,而把路易斯碱叫作电子给予体或亲核试剂。属于路易斯酸的有:①正离子,如Cu2+、Ni2+、Al3+,这些金属离子包含有可用于成键的未被占据的价轨道;②含有价层未充满的原子的化合物,如BX3,AlX3;③含有价层可扩展的原子的化合物,如SnCl4(利用外层空d轨道)。属于路易斯碱有:①阴离子;②具有孤对电子的中性分子,如NH3、H2O等;③含C=C的分子(可将电子给出)。研究发现,要判定哪一个路易斯碱强和哪一个弱,即要对路易斯碱搞一个相对的碱度系统标准是十分困难的。当用不同的酸作参比标准时,可以得到不同的碱度系统标准。如,卤素离子(碱)对Al3+离子给电子能力为:I-<Br-<Cl-<F-但卤素离子(碱)对Hg2+离子的给电子能力却有相反的顺序:F-<Cl-<Br-<I-类似的颠倒现象很多。同样,要对路易斯酸搞一个相对的酸度系统标准也是十分困难的,当用不同的碱作参比标准时,可以得到不同的酸度系统标准。具体地说,硬酸中接受电子的原子较小、正电荷高,其价电子轨道不易变形(用一句话说就是硬酸是受体原子对外层电子的吸引力强的酸)。像Al3+离子以及BF3之类的化合物都是硬酸的例子。软酸中接受电子的原子较大、正电荷数目低或者为0,以易变形的价电子轨道去接受电子(也用一句话说就是软酸是受体原子对外层电子的吸引力弱的酸)。金属原子、Hg2+离子及InCl3之类化合物即是典型的软酸。●由于一种元素的硬度通常随着其氧化态的增大而增大,氧化态越高硬度越大。因此,为了使一种处于高氧化态的元素稳定,就必须使之与硬碱如O2-、OH-或F-配位:如Fe(VI)和Pt(VI)这样的高价态能够分别在化合物K2FeO4和PtF6中得到。相反,为了使一种元素处于低氧化态,则必须用软碱如CO或PR3与元素配位。如Na[Co-1(CO)4]和Pt0[P(CH3)3]4这样的化合物中可以见到Co(-1)和Pt(0)。●软硬酸碱原理还用来判断离子性盐在水中的溶解度。例如,Li+是一种硬酸,H2O分子、F-离子为硬碱,且硬度次序是F->H2O,因而Li+与F-结合稳定,在水中溶解度小,但遇到软性较大的Cl-、Br-、I-时,Li+趋向于与H2O结合,所以LiCl、LiBr、LiI在水中溶解度较大,且四种LiX随着卤离子软性的增加而溶解度增大。相反,Ag+离子是一种软酸,它趋向于与软碱结合。所以随着卤离子半径增加,软度增大,溶解度减小。2.1.2质子酸碱和质子溶剂如下面的反应都是质子理论范畴的酸碱反应。NH4+(酸1)+NH2-(碱2)NH3(酸2)+NH3(碱1)2NH4NO3(酸1)+CaO(碱2)→Ca(NO3)2+2NH3(g)(碱1)+H2O(g)(酸2)式中的碱2为O2-在质子理论中的“物种”,意味着除了分子酸(碱)外,还包括有两类新的离子酸(碱):酸:●多元酸酸式阴离子,如HSO4-、HPO42-:HSO4-→H++SO42-HPO42-→H++PO43-●阳离子酸,如NH4+,Cr(H2O)63+:NH4+→NH3+H+Cr(H2O)63+→H++Cr(H2O)5(OH)2+碱:除了如NH3、H2O和胺等分子碱外,还有●弱酸的酸根阴离子,如Ac-,S2-,HPO42-●阳离子碱,如Al(H2O)5(OH)2+,Cu(H2O)3(OH)+等。有些物种既能给出质子显酸性,又能结合质子显碱性,如H2O→OH-+H+H2O+H+→H3O+NH3→NH2-+H+NH3+H+→NH4+H2PO4-→HPO42-+H+H2PO4-+H+→H3PO4这些物种被称为两性物种。2质子溶剂某些溶剂同水一样,也能自身电离放出质子生成去质子后的溶剂阴离子。H2O+H2OH3O++OH-EtOH+EtOHEtOH2++EtO-HF+2HFH2F++HF2-H2SO4+H2SO4H3SO4++HSO4-显然Brosted-Lowry的定义也适合这些溶剂。因此可将这种溶剂称为质子溶剂。质子溶剂有一个显著的特点,就是他们的分子中都含有H,在一定的条件下可以作为质子给予体。质子溶剂按照主要性能一般分为三类:●类似于水的两性溶剂,如甲醇、乙醇。NH4++EtOHNH3+EtOH2+质子接受体(碱)RNH2+EtOHRNH3++EtO-质子给予体(酸)●碱性溶剂(亲核质子溶剂)NH3NH3+HOAcNH4++Ac-●酸性溶剂(亲电质子溶剂)HOAcH2SO4HCOOHHF水是最常用的溶剂。它是一个偶极分子,其介电常数很大,因此,当离子溶于水时,由于