如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
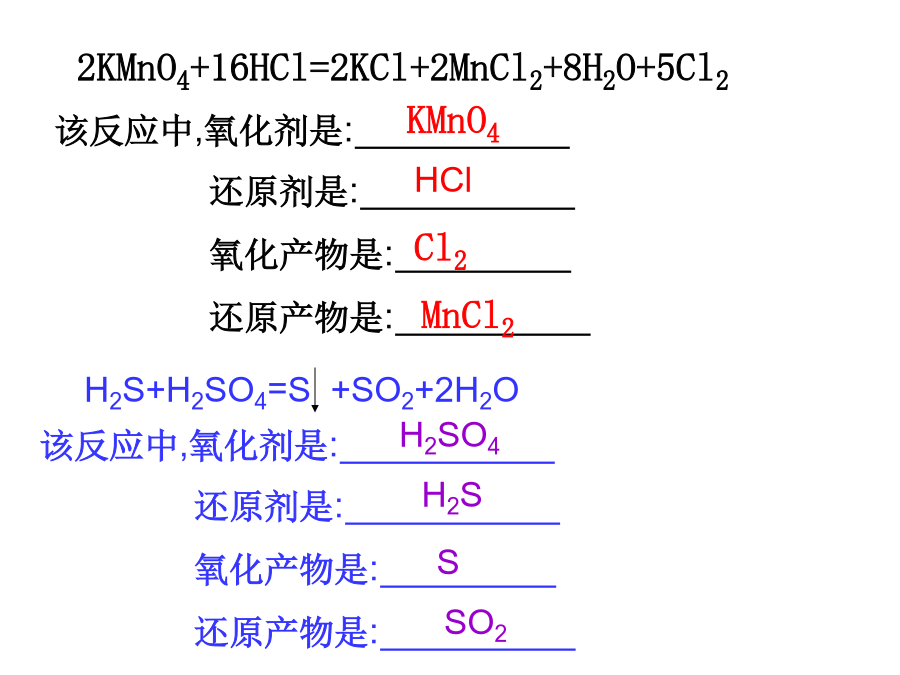
一:氧化还原反应有关概念辨析得电子、化合价降低、发生还原反应、被还原2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl22FeCl2+Cl2=2FeCl34氧化还原反应与基本反应类型的关系1、下面有关氧化还原反应的叙述正确的是()A、在反应中不一定所有元素的化合价都发生变化B、肯定有一种元素被氧化,另一种元素被还原C、某元素从化合态变为游离态,该元素一定被还原D、金属原子失电子越多,其还原性越强3.下列物质间的反应①Na+H2O;②Na2O+H2O;③NO2+H2O;④Cl2+H2O;⑤F2+H2O;⑥SO2+H2O中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是A.①③B.②⑥C.④⑤D.③④<1>重要的氧化剂(1)活泼的非金属单质,如Cl2、Br2、O2、O3(2)元素处于高化合价时的氧化物,如MnO2(3)元素处于高化合价时的含氧酸,如浓H2SO4、HNO3等。(4)元素处于高化合价时的盐,比如KMnO4、KClO3、FeCl3等。(5)过氧化物,如Na2O2、H2O2等。(6)其它的还有HClO、新制Cu(OH)2、[Ag(NH3)2]+<2>重要的还原剂(1)活泼的金属,如Na、Al、Zn、Fe等。(2)某些非金属单质,如H2、C、Si等。(3)元素处于低化合价时的氧化物,如CO、SO2(4)元素处于低化合价时的酸,如HI、H2S(5)元素处于低化合价时的盐,如Na2SO3、FeSO4三、电子转移方向和数目的表示方法2、单线桥法1、根据氧化还原方程式比较重要题型:(1)根据金属活动顺序表KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu(2)根据非金属活动顺序判断F2Cl2Br2I2S4、根据氧化还原反应的程度6、根据电化学反应原理(1)物质的浓度越高,氧化性或还原性越强。(2)温度越高,氧化性或还原性越强。(3)溶液酸碱性例题:五、氧化还原反应方程式的配平(2)逆配法:自变右边配:自身氧化还原反应如:Cl2+KOH→KClO3+KCl+H2O(3)缺项配平法:先使得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加(H+),生成物一边加水;若反应物这边缺负电荷,一般加(OH-),生成物一边则加水.然后进行两边电荷数配平。①ClO-+Fe(OH)3+=Cl-+FeO42-+H2O②MnO4-+H2O2+=Mn2++O2+H2O考点特点:考查基本落在归中反应和歧化反应上感悟高考六、氧化还原反应的一般规律例1:0.3molCu2S与足量的硝酸反应,生成硝酸铜、硫酸、一氧化氮和水,则参加反应的硝酸中被还原的硝酸的物质的量为()A.0.9molB.1molC.1.2molD.2.2mol2、难易律—越易失电子的物质,失电子后就越难得电子,越易得电子的物质,得电子后就越难失去电子。将Fe,Cu粉与FeCl3,FeCl2,CuCl2的混合溶液放在某一容器里,根据下述情况判断哪些阳离子或金属单质同时存在,哪些不能同时存在。(1)反应后铁有剩余,则容器里可能有__________(2)反应后有Cu2+和Cu,则容器里不可能有_______(3)反应后有Cu2+,Fe3+,则容器里不可能有______4、转化律——同种元素不同价态之间发生反应氧化还原反应时,元素的化合价“只靠拢,不交叉”;同种元素,相邻价态间不发生氧化还原反应。感悟高考:感悟高考: