如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
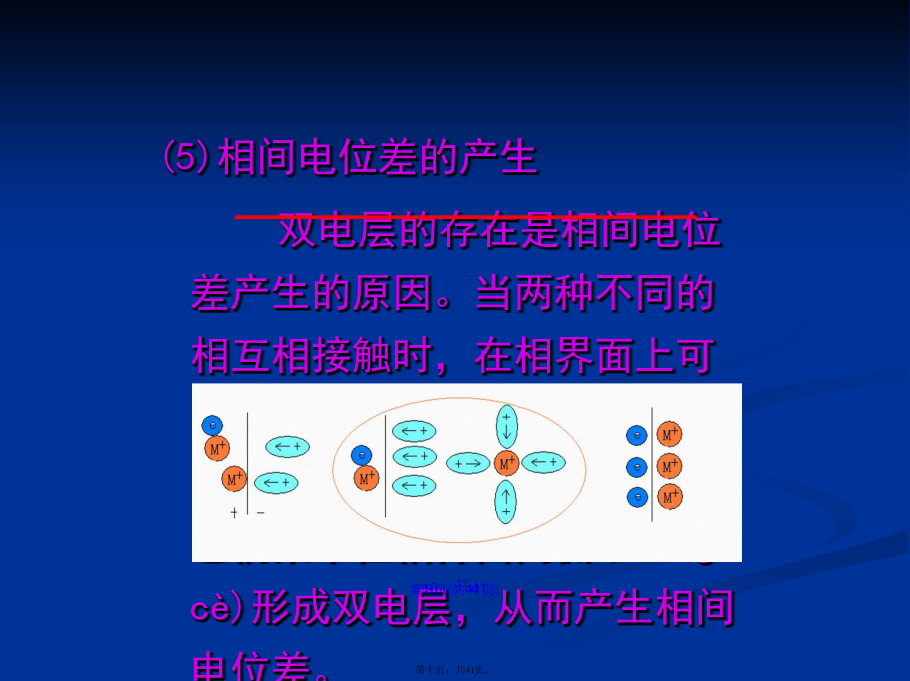
会计学第二章金属(jīnshǔ)电化学腐蚀倾向的判断1.电极电位2.金属(jīnshǔ)电化学腐蚀倾向的判断3.电位-pH图4.腐蚀原电池5.腐蚀原电池的类型§1.电极(diànjí)电位1.电位和电位差2.相内电位(diànwèi)和电化学位(1)相内电位(diànwèi)(2)电化学位将1mol带电离子Mn+自无穷远处移入到物体(wùtǐ)相M内部,所涉及的化学功和电功之和能量。则两相的电位差为:ΔΦ(I-II)=Φ(I)-Φ(II)不可测=Ψ(I)-Ψ(II)+Χ(I)-Χ(II)若I/II相化学成分相同时,由于无化学作用,所以:ΔΦ(I-II)=Ψ(I)-Ψ(II)可测(利用这一点(yīdiǎn),可以进行电池电动势的测量)绝对(juéduì)电极电位(4)相对电极电位通过测量(cèliáng)电池电动势的方法测出电极电位的相对变化值.例:Cu|Zn|ZnSO4(a1)||H2,H+(a2)|Pt|Cu(V')(I)(II)(III)(IV)(V)E=(Φ(V’)-Φ(I))+(Φ(I)-Φ(II))+(Φ(II)-Φ(III))+(Φ(III)-Φ(IV))+(Φ(IV)-Φ(V))=(Φ(V’)-Φ(II))+(Φ(II)-Φ(III))+(Φ(III)-Φ(V))=ΔΦZn-ΔΦH=φZn-φH=φZn/(5)相间电位差的产生双电层的存在是相间电位差产生的原因。当两种不同的相互相接触时,在相界面上可能发生带电粒子的转移,结果在两相中都会产生剩余电荷,它们集中在相界面两侧(liǎnɡcè)形成双电层,从而产生相间电位差。偶极分子在界面的定相排列或表面原子或分子极化双电层类型(1)赫姆荷茨双电层(紧密(jǐnmì)双电层)(2)斯特恩模型双电层(紧密(jǐnmì)-分散双电层)(6)平衡(pínghéng)电极电位化学热力学:化学位不同相间粒子转移,粒子自发地从高化学位相转入低化学位相,直到两相化学位相等。ii=0电化学:在电场作用下,两相电化学位不同相间粒子转移,带电粒子自发的从高电化学位相转入低电化学位相,直到两相的电化学位相等。ii=0以Cu(IV’)|Zn(I)|ZnSO4(a1)(II)为例:I/II相:Zn2+(I)≒Zn2+(II)∴IV’/I相:2e(I)≒2e(II)∴FeFe2++2eFe2++2eFe§2金属电化学腐蚀(fǔshí)倾向的判断(3种判断方法)(2)由标准电极电位可判断腐蚀倾向性G=-nFEo=-nF(Eo+-Eo-)电池所作最大功(电功)等于该体系自由能的减少(jiǎnshǎo)。如:Cu2++Zn=Cu+Zn2+则:G=-nFEo=-nF(Eo,Cu-Eo,Zn)=-2X96500X(0.34+0.76)/4.184=-50,731Cal由标准电极电位可判断腐蚀的倾向,即若金属的标准电极电位比介质中某一物质的标准电极电位更负则可发生腐蚀。反之,不可能发生腐蚀。(3)中性无氧稳定(wěndìng),酸性/中性有氧不稳定(wěndìng)Sn-4e+0.007Cu-2e+0.337Co-3e+0.418Cu-e+0.521Pb-4e+0.784Ag-e+0.799pH=7O2+4e+0.815V注意:热力学数据只能判断腐蚀发生的趋势、倾向,不能知道其实际速度。对实际体系状态或钝化膜等复杂体系不能用标准状态的热力学数据。合金材料热力学数据不同。不是标准情况,一般可用标准电极电位判定(pàndìng)腐蚀倾向性,(因浓度变化对电位影响不大)。§3电位-pH图在金属腐蚀(jīnshǔfǔshí)过程中-电位是控制金属离子化过程的因素-pH值是控制膜稳定性的因素应用这两个因素,可将金属与水溶液之间大量的复杂均相和非均相化学反应及电化学反应在给定条件下的平衡关系简明地表示在平面图中定义:以电位(diànwèi)(平衡电极电位(diànwèi),相对于标准氢电极)为综坐标,以pH为横坐标的电化学平衡图,又称布拜图物理意义:给出反应的平衡电极电位(diànwèi)与pH关系应用:-可以直接判断在给定条件下反应进行的可能性-图中明确地表示出在某一电位(diànwèi)和pH条件下,体系的稳定物态或平衡物态-可从热力学上很方便地判定在一定的电位(diànwèi)和pH条件下金属材料发生腐蚀的可能性1.氢电极(diànjí)、氧电极(diànjí)的水系E-pH图2.Fe-H2O系的三类(sānlèi)平衡关系式(2)无H+参与(cānyù)的电极反应例:Fe=Fe2++2eFe2+=Fe3++e这类反应的特点是只有电子交换,不产生氢