如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
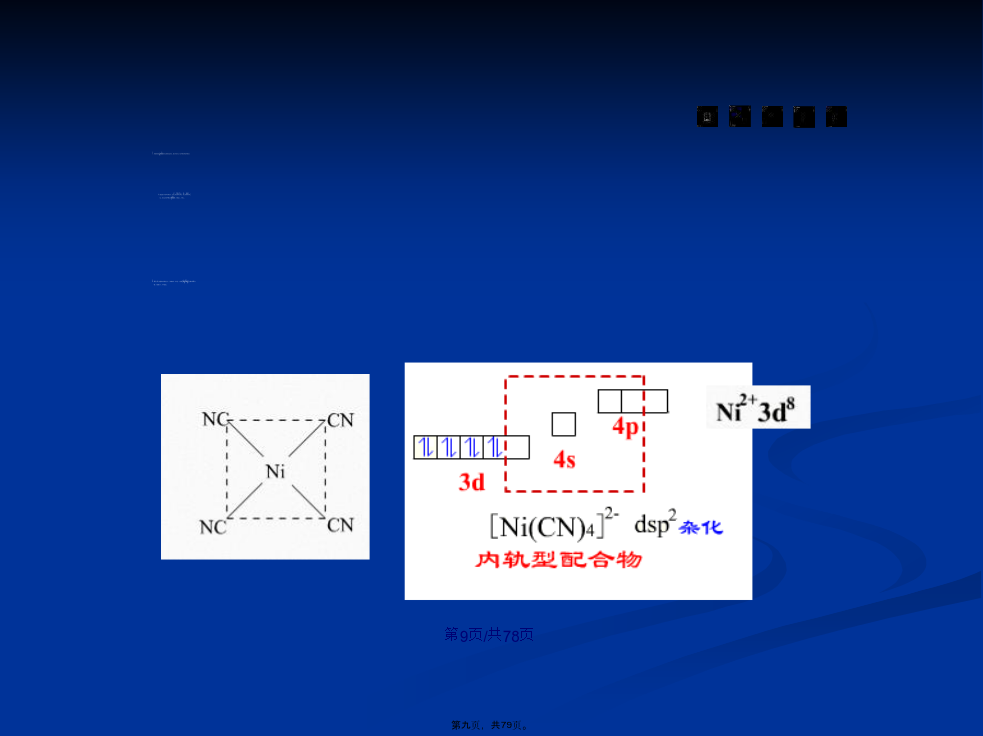
会计学1配位(pèiwèi)化合物的基本概念1.中心离子或原子(也称形成体)有空轨道过渡金属(jīnshǔ)、硼、硅、磷(如Na[BF4]和NH4[PF6]以及中性原子作形成体(如[Ni(CO)4]、[Fe(CO)5])。1.2配位(pèiwèi)化合物的命名1.配位(pèiwèi)阴离子配合物K2[SiF6]六氟合硅(Ⅳ)酸钾Na[Co(CO)4]四羰基合钴(Ⅲ)酸钠2配位(pèiwèi)化合物的化学健理论配位数杂化轨道类型空间构形配离子类型实例/例用价健理论说明Zn(CN)42-离子的空间(kōngjiān)构型及其磁矩大小.八面体场中的d轨道(guǐdào)d轨道(guǐdào)在正八面体场内的能级分裂dn3配离子(lízǐ)在溶液中的解离平衡3.1配位(pèiwèi)平衡常数3.逐级稳定(wěndìng)常数4.累积(lěijī)稳定常数(βn)例比较0.10mol·L-1[Ag(NH3)2]+溶液(róngyè)和含有0.2mol·L-1NH3的0.10mol·L-1[Ag(NH3)2]+溶液(róngyè)中Ag+的浓度。设在0.2mol·L-1NH3存在下,Ag+的浓度为ymol·L-1,则:Ag++2NH3[Ag(NH3)2]2+起始浓度/mol·L-!00.20.1平衡(pínghéng)浓度/mo1.·L-1y0.2+2y0.1-y由于c(Ag+)较小,所以(0.1-y)mol·L-!≈0.1mol·L-!,0.2+2y≈0.2mol·L-!,将平衡(pínghéng)浓度代入稳定常数表达式:3.2配位平衡(pínghéng)的移动Fe3++6F-[FeF6]3-+3OH-Fe(OH)3↓3.氧化还原(huányuán)反应与配位平衡例计算(jìsuàn)[Ag(NH3)2]++eAg+2NH3的标准电极电势。②求φ{Ag(NH3)+/Ag}φ(Ag+/Ag)=φ(Ag+/Ag)+0.059/nlgc(Ag+)=0.799+0.059lg9210-8=0.382V根据标准电极电势的定义,c([Ag(NH3)2]+)=c(NH3)=1mol·L-1时,φ(Ag+/Ag)就是(jiùshì)电极反应[Ae(NH3)2]++eAg+2NH3的标准电极电势。即φ{Ag(NH3)+/Ag}=0.382V4螯合物/4.2螯合效应5配位(pèiwèi)滴定法5.2乙二胺四乙酸在溶液(róngyè)中的解离平衡HY3-H++Y4-5.3乙二胺四乙酸与金属(jīnshǔ)离子的配位平衡5.4乙二胺四乙酸配合(pèihé)物的条件平衡常数1.酸效应(xiàoyìng)EDTA在不同(bùtónꞬ)pH条件时的酸效应系数例计算(jìsuàn)pH=11.0,c(NH3)=0.10mol.L-时的αM值。3.配合(pèihé)物的条件平衡常数例计算在pH=2和pH=5时,ZnY的条件(tiáojiàn)稳定常数6配位(pèiwèi)滴定曲线EDTA滴定Ca2+的滴定曲线(qūxiàn)金属离子浓度对滴定曲线(qūxiàn)的影响6.2配位(pèiwèi)滴定所允许的最低pH值和酸效应曲线可以找出单独滴定某一金属离子所需的最低pH值。可以看出在一定pH值时,哪些离子被滴定,哪些离子有干扰.从而可以利用(lìyòng)控制酸度,达到分别滴定或连续滴定的目的。7金属(jīnshǔ)指示剂金属离子与指示剂稳定性应小于Y4-与金属离子所生成配合(pèihé)物的稳定性,一般Kf值要小二个数量级。8配位(pèiwèi)滴定的应用2提高(tígāo)配位滴定选择性的方法77感谢您的观看(guānkàn)!内容(nèiróng)总结