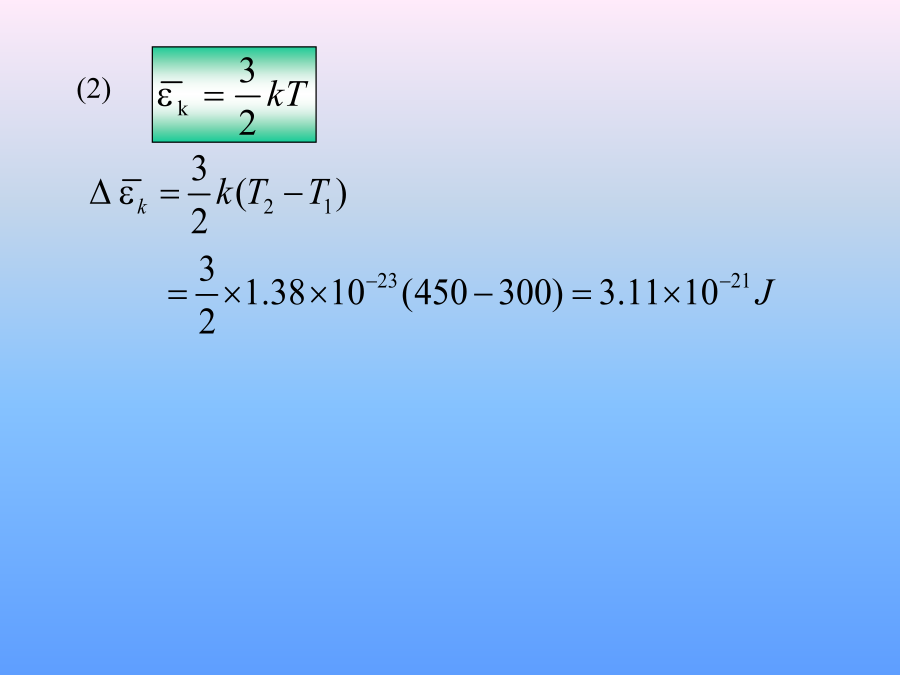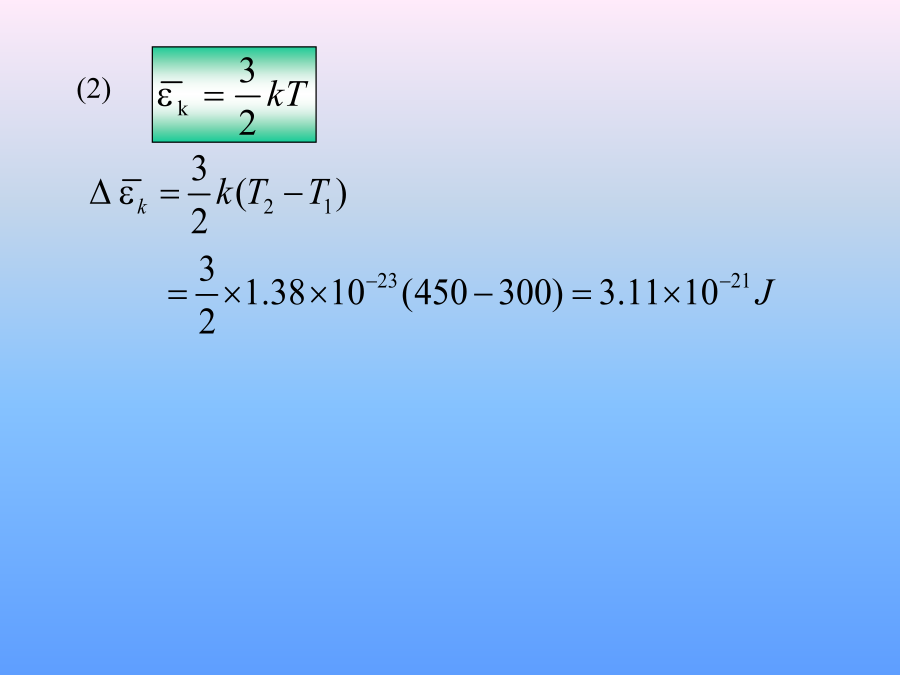如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
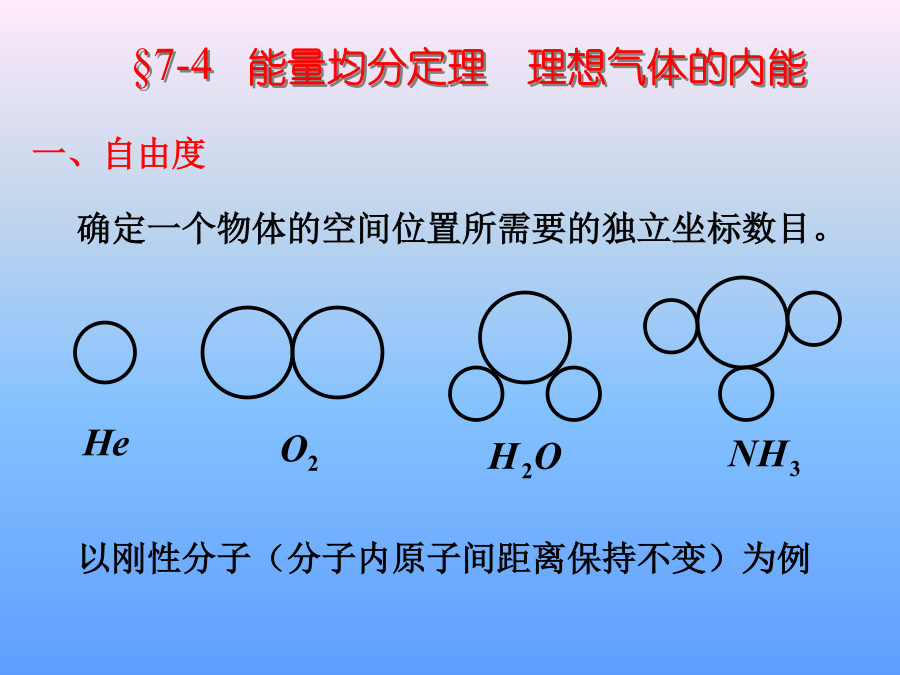
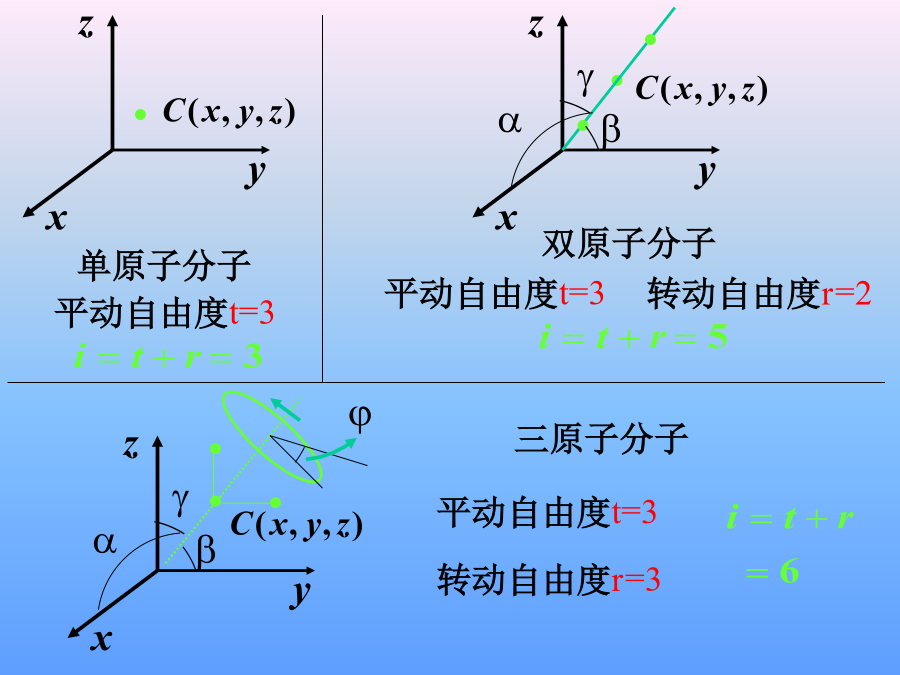
本次课内容§7-3温度的统计解释§7-4理想气体的内能、能量均分定理一、温度的统计解释(A)温度相同、压强相同。(B)温度、压强都不同。(C)温度相同,但氦气的压强大于氮气的压强.(D)温度相同,但氦气的压强小于氮气的压强.例理想气体体积为V,压强为p,温度为T,一个分子的质量为m,k为玻尔兹曼常量,R为摩尔气体常量,则该理想气体的分子数为:例:(1)在一个具有活塞的容器中盛有一定的气体。如果压缩气体并对它加热,使它的温度从270C升到1770C,体积减少一半,求气体压强变化多少?(2)这时气体分子的平均平动动能变化多少?(2)二、气体分子的方均根速率一、自由度2、能量均分定理(2.)平衡态各自由度地位相等每一转动自由度每一振动自由度也具有与平动自由度相同的平均动能,其值也为3.表述在温度为T的平衡态下物质(汽液固)分子每个自由度具有相同的平均动能3)由能均分原理可得平衡态下每个分子的平均动能一般:刚性单原子分子双原子分子多原子分子单原子分子303双原子分子325多原子分子3363、理想气体的内能N个粒子组成的系统分子热运动能量1mol理想气体的内能1)一般情况下不加说明把分子看作刚性分子例就质量而言,空气是由76%的N2,23%的O2和1%的Ar三种气体组成,它们的分子量分别为28、32、40。空气的摩尔质量为28.910-3kg,试计算1mol空气在标准状态下的内能。Ar质量例2.一定量的理想气体贮于某一容器中,温度为T,气体分子的质量为m.根据理想气体的分子模型和统计假设,分子速度在x方向的分量平方的平均值例4.一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为p1和p2,则两者的大小关系是:(A)p1>p2.(B)p1<p2.(C)p1=p2.(D)不确定的.例5.一容器内装有N1个单原子理想气体分子和N2个刚性双原子理想气体分子,当该系统处在温度为T的平衡态时,其内能为kg/m3例7.容器内混有二氧化碳和氧气两种气体,混合气体的温度是290K,内能是9.64×105J,总质量是5.4kg,试分别求二氧化碳和氧气的质量.