如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
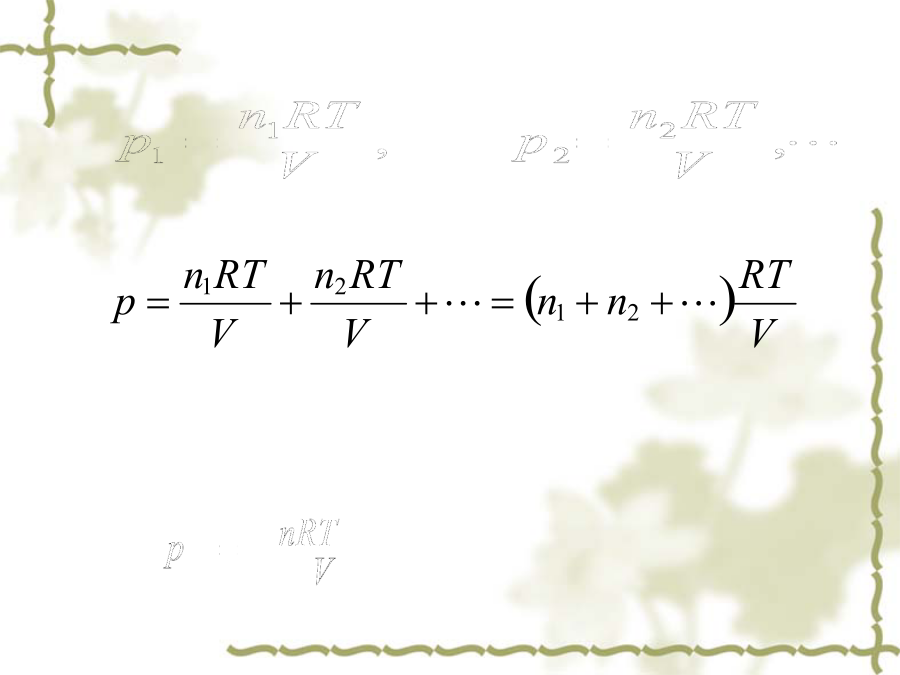
1.1.1理想气体状态方程气体的最基本特征:具有可压缩性和扩散性。pV=nRTR——摩尔气体常数在STP下,p=101.325kPa,T=273.15Kn=1.0mol时,Vm=22.414L=22.414×10-3m31.计算p,V,T,n中的任意物理量=1.2.1分压定律组分气体:理想气体混合物中每一种气体叫做组分气体。分压:组分气体B在相同温度下占有与混合气体相同体积时所产生的压力,叫做组分气体B的分压。分压定律:n=n1+n2+分压的求解:例题:某容器中含有NH3、O2、N2等气体的混合物。取样分析后,其中n(NH3)=0.320mol,n(O2)=0.180mol,n(N2)=0.700mol。混合气体的总压p=133.0kPa。试计算各组分气体的分压。p(N2)=p-p(NH3)-p(O2)=(133.0-35.5-20.0)kPa=77.5kPa分压定律的应用例题:用金属锌与盐酸反应制取氢气。在25℃下,用排水集气法收集氢气,集气瓶中气体压力为98.70kPa(25℃时,水的饱和蒸气压为3.17kPa),体积为2.50L。计算反应中消耗锌的质量。Zn(s)+2HClZnCl2+H2(g)65.39g1molm(Zn)=?0.0964mol分体积:混合气体中某一组分B的分体积VB是该组分单独存在并具有与混合气体相同温度和压力时所占有的体积。V=V1+V2+例题:天然气是多组分的混合物,其组成为:CH4,C2H6,C3H8和C4H10。若该混合气体的温度为25℃。总压力为150.0kPa,n总=100.0mol。n(CH4):n(C2H6):n(C3H8):n(C4H10)=47.0:2.0:0.80:0.20。计算各组分的分体积和体积分数。n(CH4)=x(CH4)·n总解法二:理想气体状态方程仅在足够低的压力下适合于真实气体。a,b称为vanderWaals常量。表1-1某些气体的vanderWaals常量例题:分别按理想气体状态方程和vanderWaals方程计算1.50molSO2在30℃有20.0L体积时的压力,并比较两者的相对误差。如果体积减少至2.00L,其相对误差又如何?′