如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
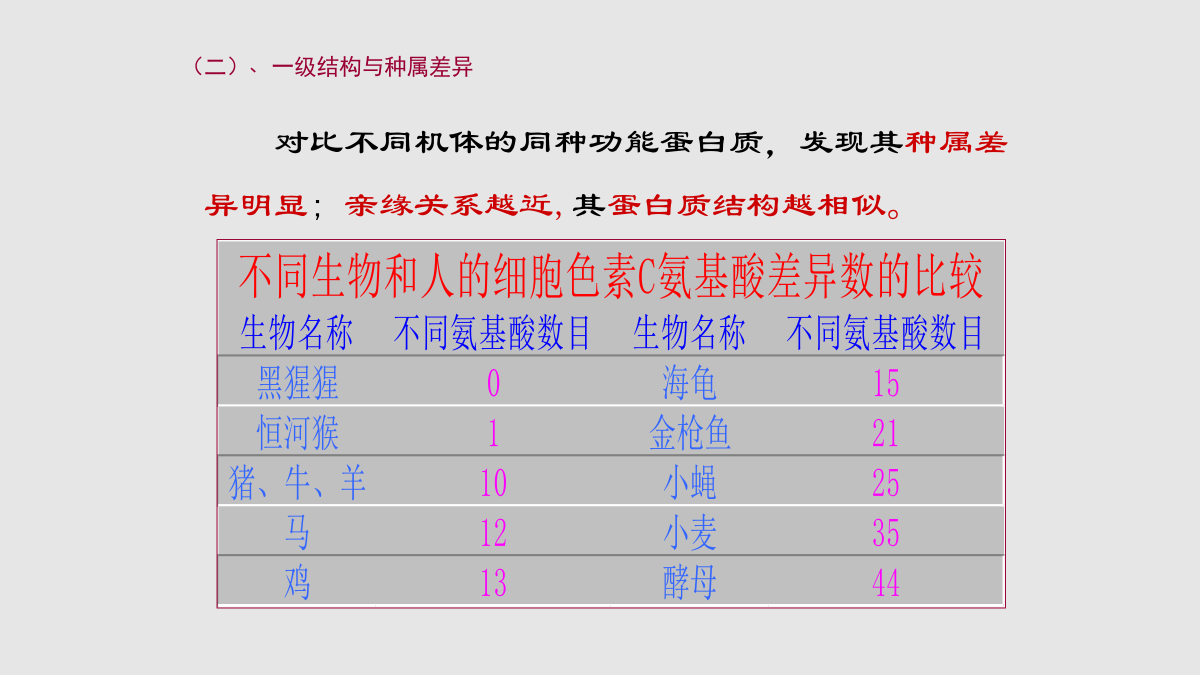
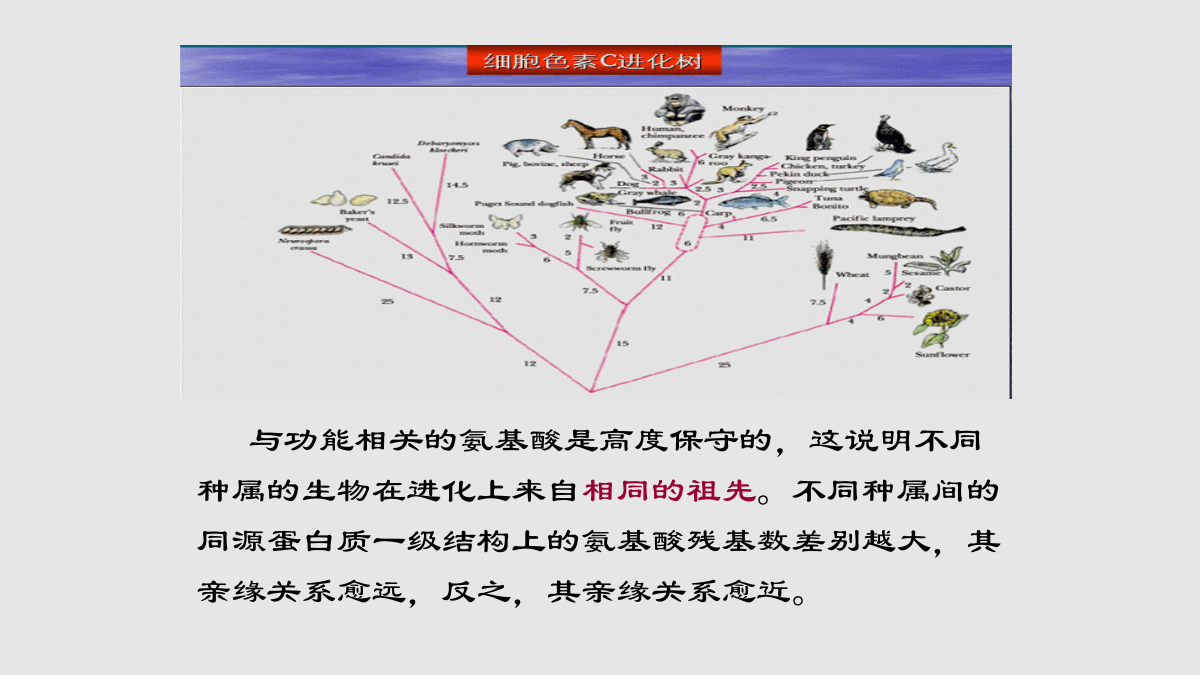
§2.4蛋白质结构与功能的关系一、蛋白质一级结构与功能的关系二、蛋白质的空间结构与功能的关系§2.5蛋白质的性质与分离、纯化技术一、蛋白质的性质二、蛋白质的分离纯化技术(一)、一级结构的变异与分子病(二)、一级结构与种属差异与功能相关的氨基酸是高度保守的,这说明不同种属的生物在进化上来自相同的祖先。不同种属间的同源蛋白质一级结构上的氨基酸残基数差别越大,其亲缘关系愈远,反之,其亲缘关系愈近。(三)、一级结构的局部断裂与蛋白质激活:二、蛋白质空间结构与功能的关系天然状态,有催化活性(二)血红蛋白的别构效应血红蛋白的亚基铁卟啉别构效应(allostericeffect)*协同效应(cooperativity)(三)蛋白质构象改变与疾病蛋白质构象病的机理:有些蛋白质错误折叠后相互聚集,常形成抗蛋白水解酶的淀粉样纤维沉淀,产生毒性而致病,表现为蛋白质淀粉样纤维沉淀的病理改变。亨廷顿舞蹈病疯牛病疯牛病是由朊病毒蛋白(prionprotein,PrP)引起的一种人和动物神经退行性病变。正常的PrP富含α-螺旋,称为PrPc。PrPc在某种未知蛋白质的作用下可转变成全为β-折叠的PrPsc,从而致病。一级结构一、蛋白质的两性电离蛋白质的等电点(isoelectricpoint,pI)当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH称为蛋白质的等电点。蛋白质属于生物大分子之一,分子量可自1万至100万之巨,其分子的直径可达1-100nm,为胶粒范围之内。蛋白质沉淀方法:2.有机溶剂沉淀法:条件:有机溶剂如乙醇、丙酮等。机理:破坏蛋白质的水化膜。注意:低温条件下进行,否则溶解热会使蛋白质变性。3.重金属盐沉淀条件:pH稍大于pI为宜;机理:重金属盐加入之后,与带负电的羧基结合。注意:蛋白质变性,长期从事重金属作业的人应多吃高蛋白食品,以防止重金属离子被机体吸收后造成对机体的损害。4.生物碱试剂沉淀法条件:pH稍小于pI;生物碱试剂一般为弱酸性物质,如单宁酸、苦味酸、三氯乙酸等。机理:在酸性条件下,蛋白质带正电,可以与生物碱试剂的酸根离子结合而产生沉淀。“柿石症”的产生就是由于空腹吃了大量的柿子,柿子中含有大量的单宁酸,使肠胃中的蛋白质凝固变性而成为不能被消化的“柿石”。5.弱酸或弱碱沉淀法:条件:pH=pI机理:破坏蛋白质表面净电荷。三、蛋白质的变性、沉淀和凝固造成变性的因素:1)物理因素:高温、高压、射线等;2)化学因素:强酸、强碱、重金属盐等。蛋白质变性后的性质改变:溶解度降低、粘度增加、结晶能力消失、生物活性丧失及易受蛋白酶水解。若蛋白质变性程度较轻,去除变性因素后,蛋白质仍可恢复或部分恢复其原有的构象和功能,称为复性。天然状态,有催化活性*蛋白质变性易沉淀在一定条件下,蛋白疏水侧链暴露在外,肽链会相互缠绕继而聚集,因而从溶液中析出。变性的蛋白质易于沉淀,有时蛋白质发生沉淀,但并不变性。*蛋白质的凝固作用(proteincoagulation)蛋白质变性后的絮状物加热可变成比较坚固的凝块,此凝块不易再溶于强酸和强碱中。由于蛋白质分子中含有共轭双键的酪氨酸和色氨酸,因此在280nm波长处有特征性吸收峰。蛋白质的OD280与其浓度呈正比关系,因此可作蛋白质定量测定。五、蛋白质的呈色反应(一)分离纯化蛋白质的意义1.原料的选择:要求含待分离的蛋白质丰富,廉价,容易收集,新鲜无腐败。2.原料的预处理:胞外蛋白质,材料破碎后,用适当的溶剂直接抽提;胞内蛋白质,则需要破碎细胞膜,再用适当的溶剂抽提。3.从抽提液中沉淀蛋白质:常用盐析法、低温乙醇沉淀法、等电点沉淀法。4.纯化:将沉淀的蛋白质溶解,再选择适当的纯化方法,得到纯度比较高的蛋白质溶液。方法:透析或超滤、电泳法、凝胶过滤法、离子交换层析、吸附层析法、超速离心法等。5.蛋白质的结晶:从溶液中重新沉淀蛋白质。(三)蛋白质的分离和纯化方法*使用丙酮沉淀时,必须在0-4℃低温下进行,丙酮用量一般10倍于蛋白质溶液体积。蛋白质被丙酮沉淀后,应立即分离。3.电泳(elctrophoresis)几种重要的蛋白质电泳*SDS-聚丙烯酰胺凝胶电泳:常用于蛋白质分子量的测定。*等电聚焦电泳:通过蛋白质等电点的差异而分离蛋白质的电泳方法。*双向凝胶电泳:是蛋白质组学研究的重要技术。层析(chromatography)分离蛋白质的原理待分离蛋白质溶液由(流动相)经过一个固态物质(固定相)时,根据溶液中待分离的蛋白质颗粒大小、电荷多少及亲和力等,使待分离的蛋白质组分在两相中反复分配,并以不同速度流经固定相而达到分离蛋白质的目的。蛋白质分离常用的层析方法*离子交换层析:利用各蛋白质