如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
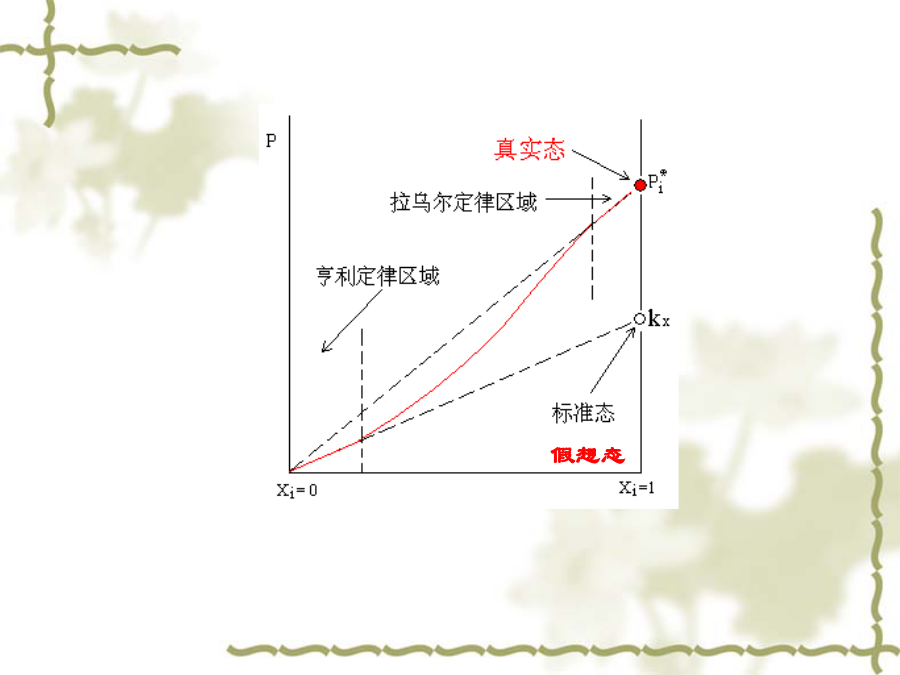
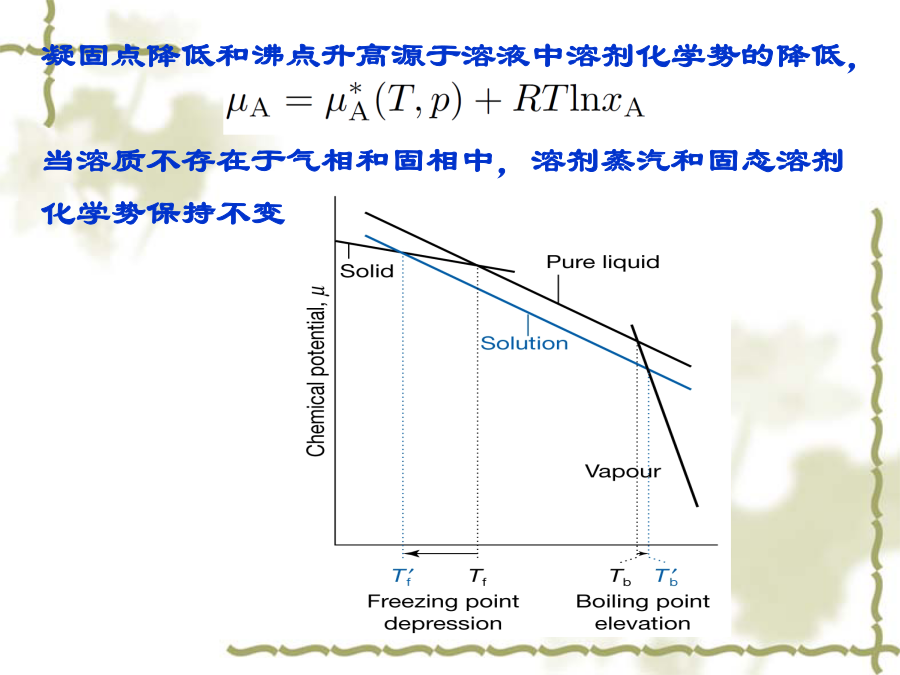
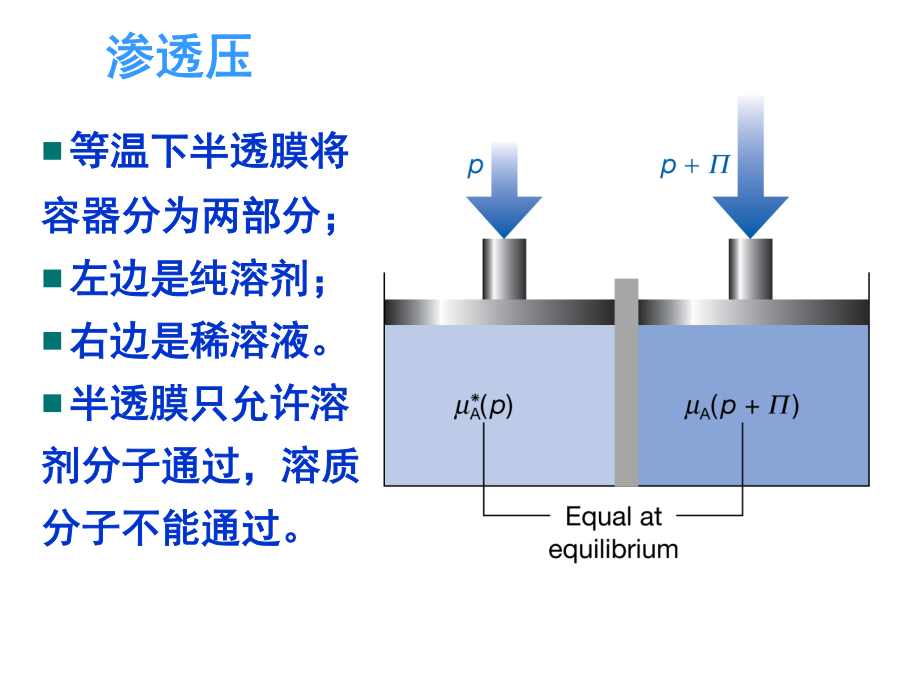
一、理想稀溶液溶剂和溶质的化学势溶质的化学势(i)假想态溶质的化学势(ii)溶质的化学势(iii)总结二、稀溶液的依数性凝固点降低和沸点升高源于溶液中溶剂化学势的降低,当溶质不存在于气相和固相中,溶剂蒸汽和固态溶剂化学势保持不变渗透压第四节非理想溶液1.非理想液态混合物或稀溶液中的溶剂理想pA=pA*xA非理想pA=pA*xAx,A=pA*aA活度因子x,A和活度aA:aA=x,AxAxA1,x,A1,aAxA化学势2.稀溶液中的溶质理想pB=kxxB非理想pB=kxxBx,B=kxax,B活度因子x,B和活度ax,B:aB=x,BxBxB0,x,B1,ax,BxB化学势亨利定律稀溶液:pB=kmmB非理想:pB=kmmBm,BB=B+RTln(mBm,B/m)=B(T,p)+RTlnam,B亨利定律稀溶液:pB=kccB非理想:pB=kccBc,BB=B+RTln(cBc,B/c)=B(T,p)+RTlnac,B引入活度a及活度系数,化学势保持理想情况下的公式形式活度和活度系数都是无量纲量不同的浓度单位,对应的活度和活度系数的值就不同,相应的标准态化学势的值也不同二、活度的测定二、活度的测定三、渗透因子(表示溶剂的非理想程度)四、超额函数已知:理想溶液例如:GE=HE-TSE非理想(实际)溶液:x,i为组分i对Raoult定律的偏差校正(不论溶质或溶剂)1、正规溶液例:HE=nwxAxB=nbRTxAxB2、无热溶液五、分配定律一定温度和压力的条件下,同一溶质溶解在两个同时存在互不相溶的溶剂中,平衡时,该溶质在两相中的活度之比为定值