如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
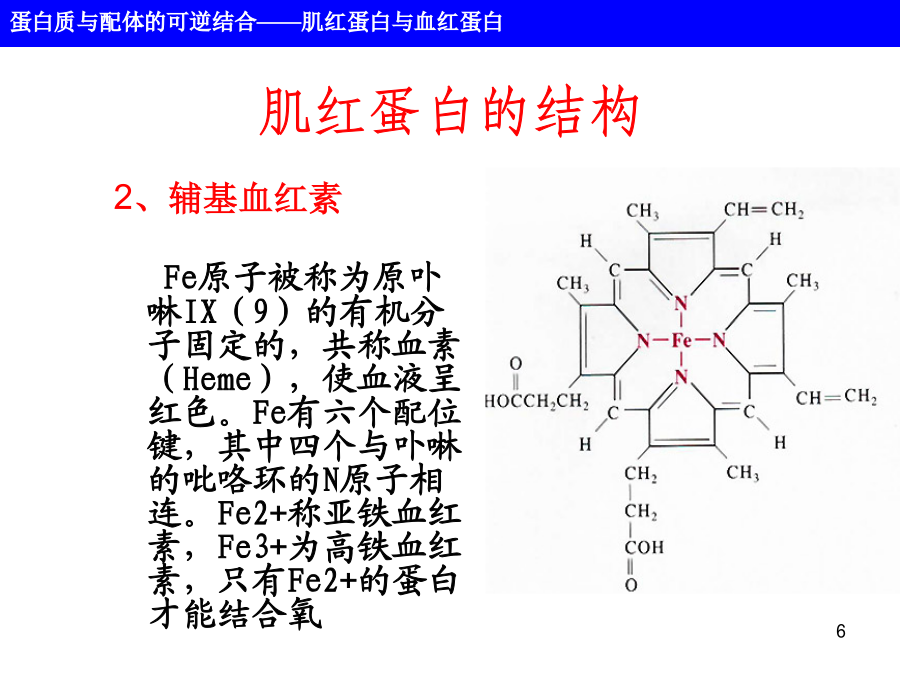
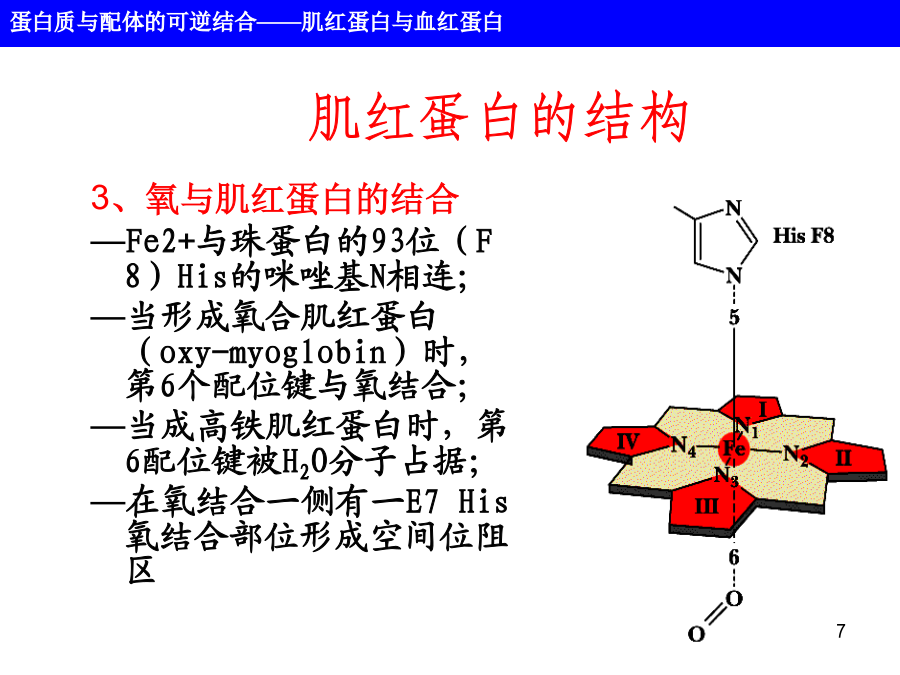
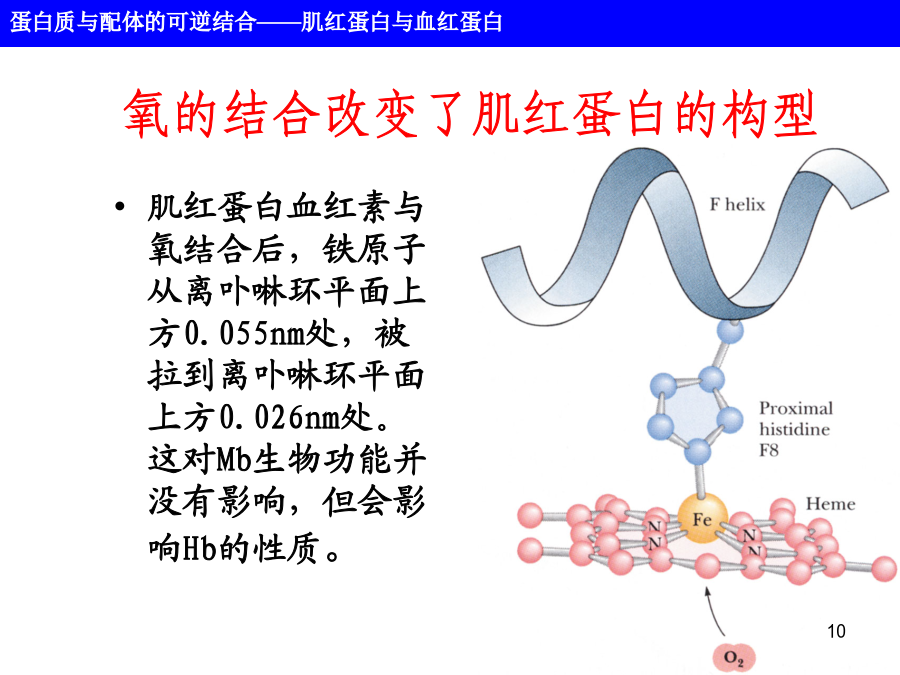
第六章蛋白质的结构和功能蛋白质不是静止的分子,而是处于不停的运动之中。蛋白质的功能几乎总是依赖于与其它分子的相互作用,这种相互作用受到蛋白质分子的构象变化的影响。主要内容1、肌红蛋白肌红蛋白的结构2、辅基血红素Fe原子被称为原卟啉IX(9)的有机分子固定的,共称血素(Heme),使血液呈红色。Fe有六个配位键,其中四个与卟啉的吡咯环的N原子相连。Fe2+称亚铁血红素,Fe3+为高铁血红素,只有Fe2+的蛋白才能结合氧3、氧与肌红蛋白的结合—Fe2+与珠蛋白的93位(F8)His的咪唑基N相连;—当形成氧合肌红蛋白(oxy-myoglobin)时,第6个配位键与氧结合;—当成高铁肌红蛋白时,第6配位键被H2O分子占据;—在氧结合一侧有一E7His氧结合部位形成空间位阻区肌红蛋白与氧的结合Mb多肽微环境的作用氧的结合改变了肌红蛋白的构型肌红蛋白氧合曲线肌红蛋白氧合曲线肌红蛋白氧合曲线肌红蛋白氧合曲线152血红蛋白血红蛋白的结构18血红蛋白4个血红素基分别位于每个多肽链的E和F螺旋之间的裂隙处,并暴露在分子的表面。氧结合引起的血红蛋白构象变化血红素铁0.039nm的微小位移导致血红蛋白构象的改变。脱氧血红蛋白(紧张态)氧合血红蛋白(松驰态)氧合导致稳定T态的离子键和盐桥的断裂,血红蛋白的氧结合过程是一协同过程。血红蛋白结合氧的协同作用示意图Hb的氧结合曲线[Hb(O2)4]Hb的氧结合曲线◇肺泡中pO2=100torr,YO2=0.97◇毛细管中pO2=20torr,YO2=0.25◇HbP50=26torr◇Hb0.97-0.25=0.72Mb0.97-0.89=0.08◇协同效应增加血红蛋白在肌肉中卸O2效率。Hill图H+、CO2和BPG对血红蛋白结合氧的影响H+和CO2促进O2的释放(Bohr效应)Bohr效应生理意义:Bohr效应示意图BPG降低Hb对O2的亲和力Hb和两个β亚基之间的离子键结合BPG和二氧化碳对Hb氧合曲线的影响BPG对Hb氧合曲线的影响胎儿和成人的血红蛋白氧合曲线镰刀状细胞贫血是分子病病因:患者的二条β链上的N-末端开始的第6位Glu被Val所取代。Hb-S比Hb-A负电荷减少,即电泳时向正极移动的速率下降。从三级结构上看,由于β6glu位于分子表面,因此HbS表面多了一疏水侧链,血红蛋白的对氧亲和力和别构性质并不受此影响,但这一变化显著地降低了脱氧血红蛋白的溶解度。疏水侧链与其互补链之间通过疏水作用而沉淀,压迫细胞质膜,使其弯曲成镰刀形状。用氰酸钾处理镰刀状的红细胞可以防止它在脱氧状态下形成镰刀状。镰刀状细胞血红蛋白可形成纤维状沉淀问题