如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
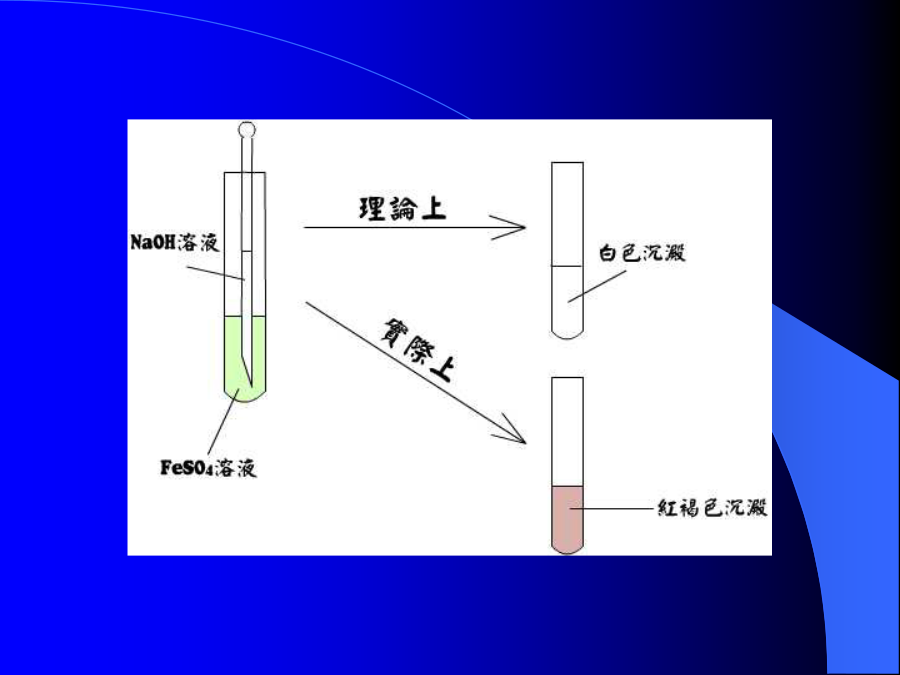
1.對“教學研究”的理解2.做“教學研究”的體會對教材的研究對教法的研究對科技熱點問題的研究3.總結:一.對“教學研究”的理解二.做“教學研究”的體會分析:4Fe(OH)2+O2+2H2O==4Fe(OH)3↓(紅褐色)溶液中的O2迅速把Fe(OH)2轉化成Fe(OH)3。解決辦法:解決辦法:例2:2Al+6HCl==2AlCl3+3H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑理論上:兩個反應都很劇烈實際上:解決辦法:例3:澱粉、蛋白質等高分子在水中形成的分散系有時稱為溶液,有時又稱為膠體互相矛盾說法一:膠體溶液中加電解質會凝聚,是不可逆過程說法二:蛋白質膠體溶液中加電解質也會聚沉,但加水后蛋白質又會重新溶解互相矛盾2.對教法的研究告知原因:鹽類發生了水解解釋:第一類水解:強鹼和弱酸生成鹽的水解,如:CH3COONa第二類水解:強酸和弱鹼生成鹽的水解,如:NH4Cl科學程序法二.解決問題(分三步)1.分析原因,尋找本質水中[H+]=[OH-],加CH3COONa出現[OH-]>[H+]為什么?2.探明因果,提出假設如果某鹽的離子能與水電離出的H+或OH-結合生成弱電解質,那么這種鹽溶液就可能顯弱鹼性或弱酸性3.實踐驗証,形成理論鹽的水解是鹽的離子與水電離出來定的H+或OH-生成弱電解質的反應。鹽的水解規律:實驗教學3.對科技熱點問題的研究2.激發學生求知的欲望3.有利于培養學生的創新意識總結謝謝!