如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
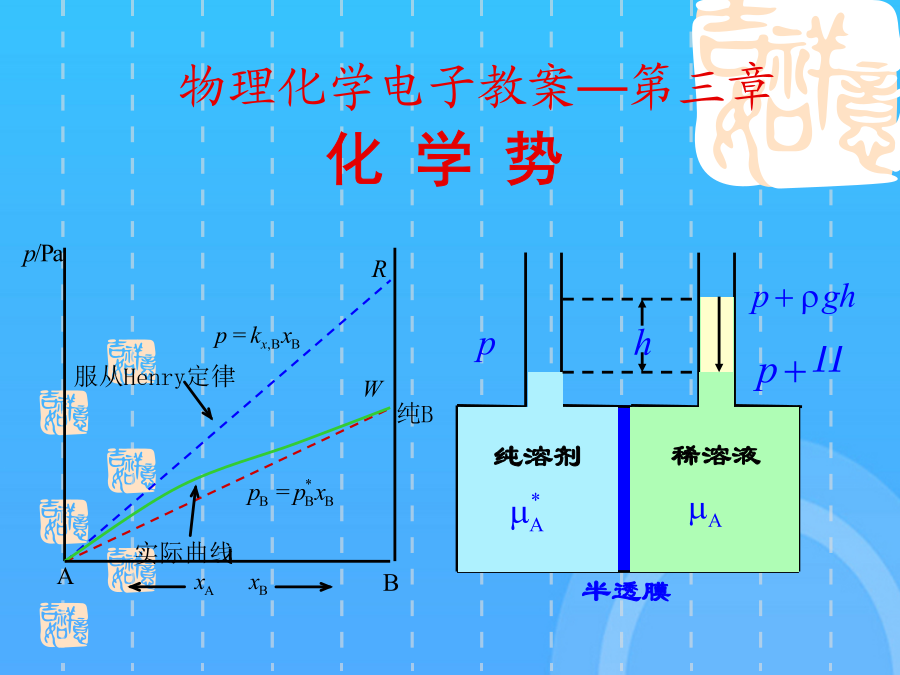
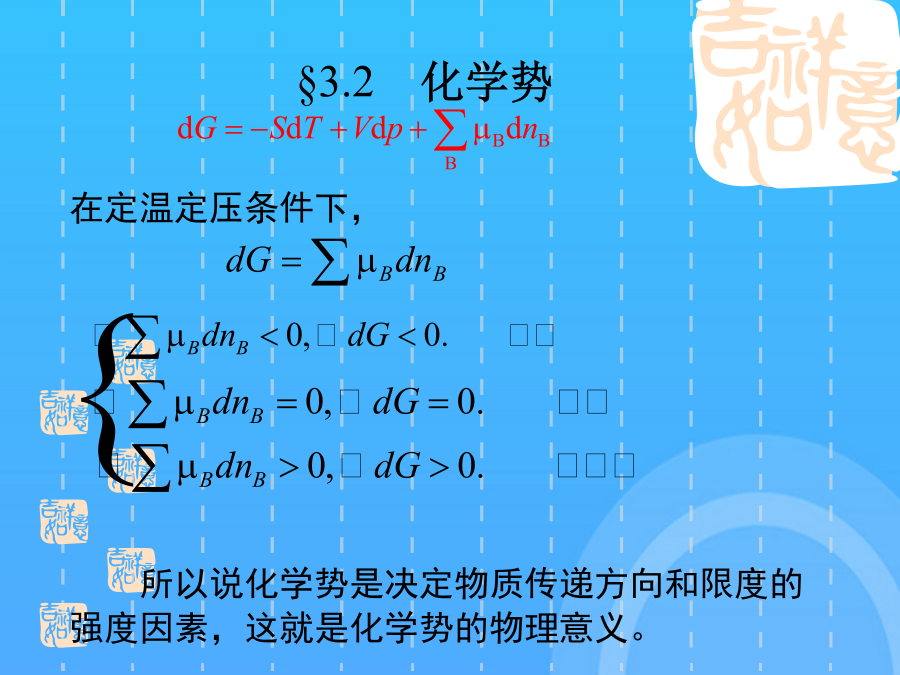
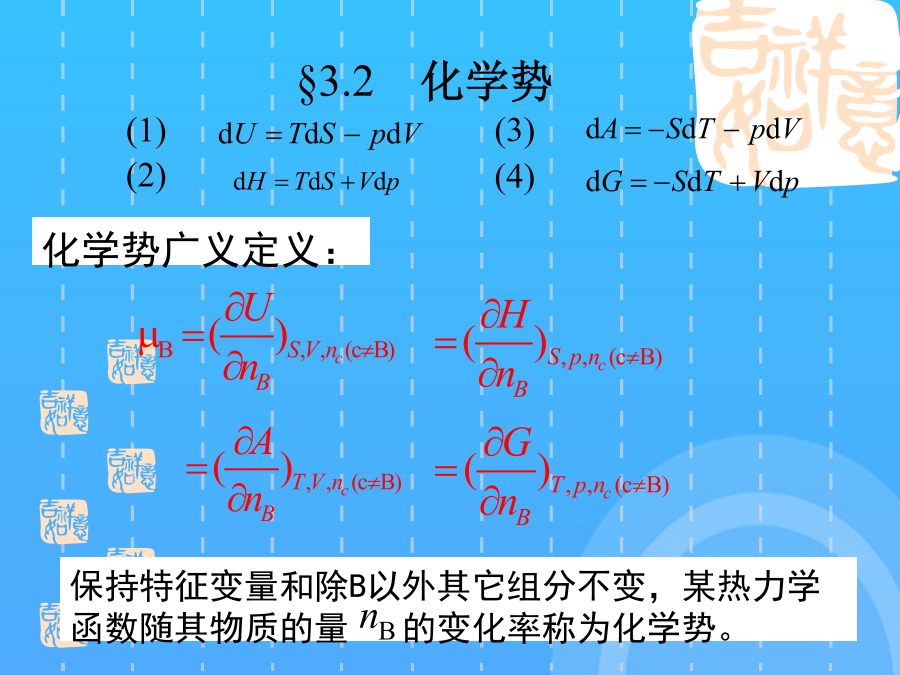
物理化学电子教案—第三章§3.1偏摩尔量1.偏摩尔量的定义使用偏摩尔量时应注意:偏摩尔量的集合公式说明体系的总的容量性质等于各组分偏摩尔量的加和。所以有:1.化学势的定义§3.2化学势在定温定压条件下,所以说化学势是决定物质传递方向和限度的强度因素,这就是化学势的物理意义。化学势广义定义:如果转移是在平衡条件下进行,那么2.化学势在相平衡中的应用3.化学势在化学平衡中的应用只有一种理想气体,这是单个理想气体化学势的表达式混合理想气体中,某种气体的行为与该气体单独占有混合气体总体积时的行为相同。所以3.实际气体的化学势——逸度的概念小结1.拉乌尔定律拉乌尔定律§3.4理想溶液中物质的化学势3.理想液态混合物中物质的化学势假设理想溶液中每种物质都是挥发性的,则当溶液与其上方蒸气平衡时纯理想气体化学势:使用亨利定律应注意:两种挥发性物质组成一溶液,在一定的温度和压力下,在一定的浓度范围内,溶剂遵守Raoult定律,溶质遵守Henry定律,这种溶液称为理想稀溶液。溶剂服从Raoult定律,是在该温度下纯溶剂的饱和蒸气压。溶质的化学势溶质的化学势溶质的化学势溶质的化学势溶质的化学势溶质的化学势小结依数性质(colligativeproperties):出现依数性的根源是:溶液凝固点降低和沸点升高的定性说明:§3.6不挥发性溶质稀溶液的依数性§3.6不挥发性溶质稀溶液的依数性为了阻止溶剂渗透,在右边施加额外压力,使半透膜双方溶剂的化学势相等而达到平衡。这个额外施加的压力就定义为渗透压。稀溶液的依数性1.实际液态混合物对理想液态混合物的偏差正偏差:实际溶液的蒸气压大于拉乌尔定律的计算值2.非理想液态混合物中各组分的化学势及活度的概念非理想稀溶液中溶质B的化学势表示式,由于浓度的表示式不同,溶质化学势表示式也略有差异。(1)浓度用摩尔分数表示偏摩尔量的集合公式说明体系的总的容量性质等于各组分偏摩尔量的加和。(3)溶液浓度愈稀,对亨利定律符合得愈好。(浓度为质量摩尔浓度)因为在从0—1的范围内不可能始终服从Henry定律,这个状态实际上不存在,但不影响的计算。对于非理想的液态混合物,Lewis提出了活度的概念化学势是T,p的函数实际气体的化学势——逸度的概念使用偏摩尔量时应注意:非理想液态混合物中各组分的化学势及活度的概念则2mol单组分B物质的体积为从分子模型上看,各组分分子大小和作用力彼此相似,在混合时没有热效应和体积变化,即或在等温、等压、保持B物质以外的所有组分的物质的量不变的有限系统中,改动所引起广度性质Z的变化值。是在T,p时,当那个状态的化学势。5理想稀溶液中物质的化学势保持特征变量和除B以外其它组分不变,某热力学函数随其物质的量的变化率称为化学势。若溶质浓度与Henry定律发生偏差,则校正为§3.7非理想溶液中物质的化学势4.溶剂活度的求算稀溶液中物质的化学势由于纯溶剂的化学势大于溶液中溶剂的化学势,所以溶剂有自左向右渗透的倾向。使用拉乌尔定律计算溶剂的蒸气压时,溶剂的摩尔质量应采用其呈气态时的摩尔质量,而不考虑分子的缔合等因素。化学势在相平衡中的应用(2〕浓度用质量摩尔浓度表示溶质实际的蒸气压曲线如实线所示负偏差的溶液中,各物质的化学势小于同浓度理想溶液中各物质的化学势3气体物质的化学势如果溶液中只有A,B两个组分,那么而1mol单组分B物质和1mol单组分C物质混合,使用偏摩尔量时应注意:系统Gibbs自由能的变化值为理想液态混合物的定义这是单个理想气体化学势的表达式5理想稀溶液中物质的化学势5理想稀溶液中物质的化学势相似点:都是从稀溶液中得出的规律;自发变化的方向是:组分B从化学势高的相转移到化学势较低的相。三.各种化学势的表示式三.各种化学势的表示式四.稀溶液的依数性谢谢