如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
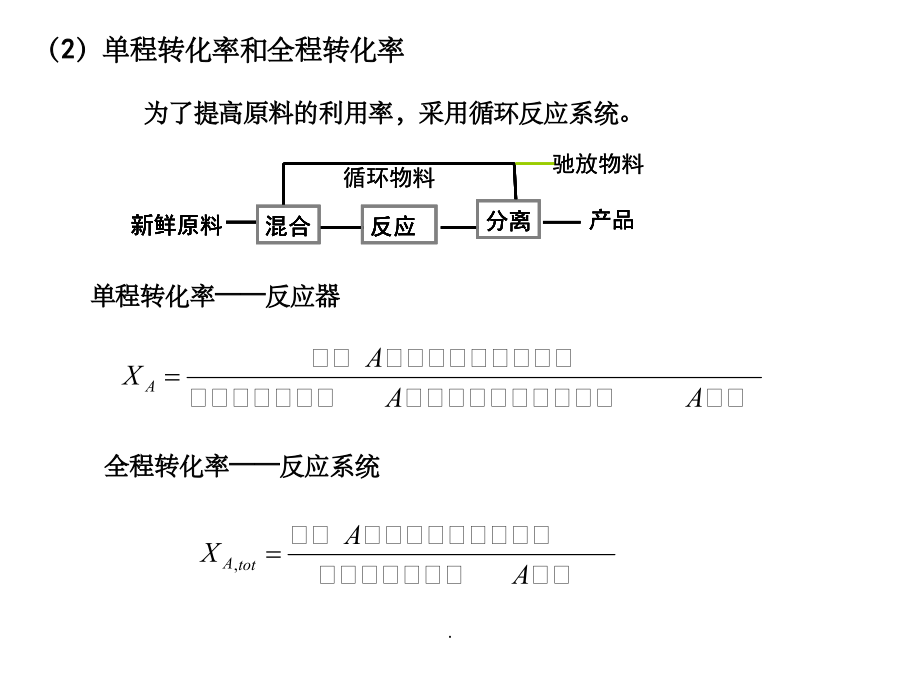
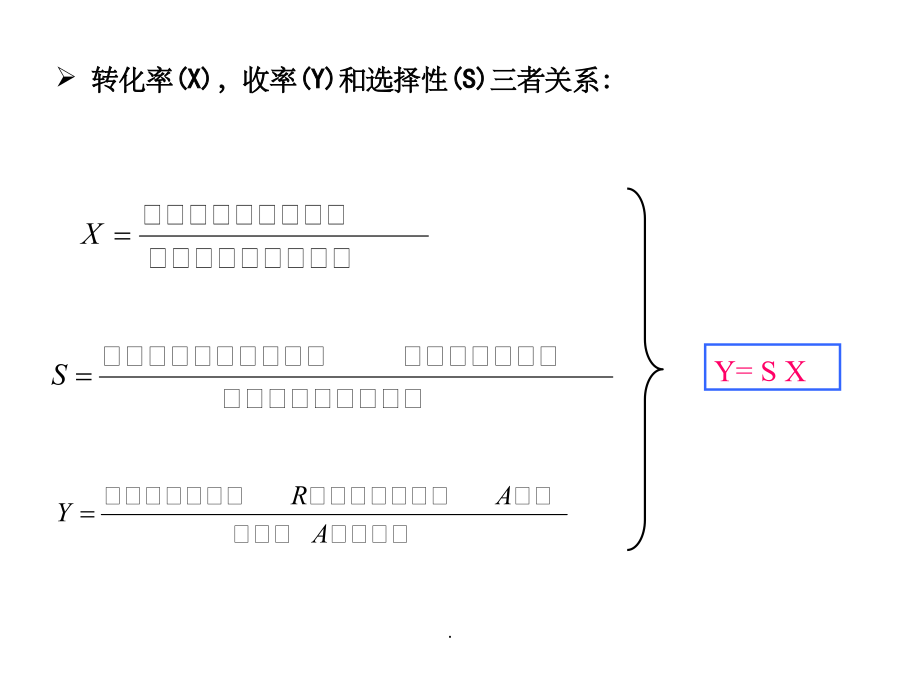
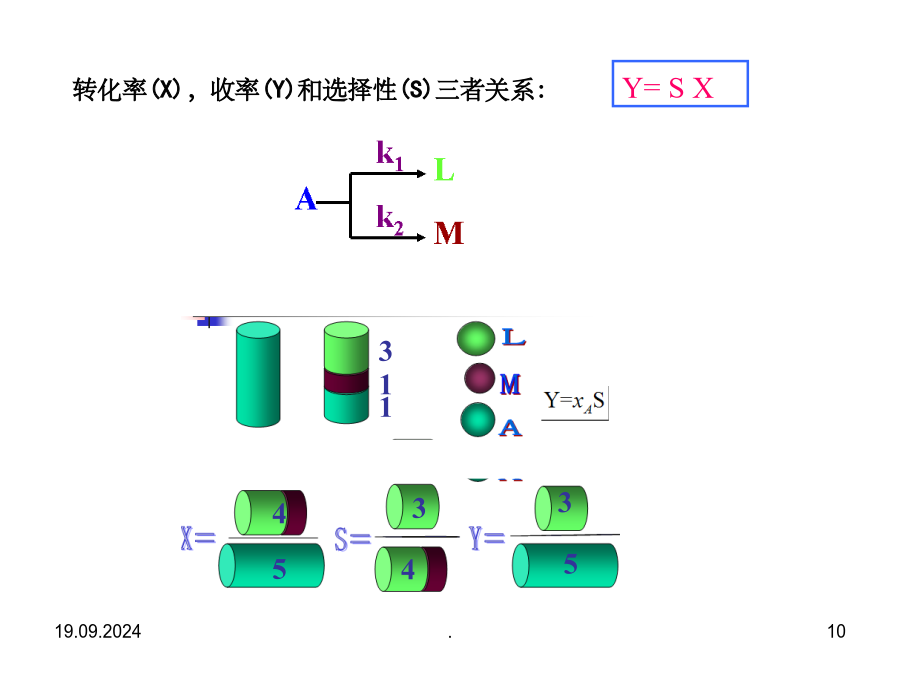
§7.1概述§7.1概述1、物料衡算和热量衡算的主要步骤(5)设未知数,列方程式,求解。(物料平衡、约束式-归一方程、气液平衡方程等。转化率、选择性和收率(2)单程转化率和全程转化率例:以乙炔与醋酸合成醋酸乙烯酯为例。如图所示,再连续生产中,假设每小时流经各物料线的物料中含乙炔的量为mA=600Kg,mB=5000Kg,mc=4450Kg,计算过程的单程转化率和全程转化率。反应选择性转化率(X),收率(Y)和选择性(S)三者关系:19.09.20241.一般反应过程的物料衡算蒸馏反应物料衡算的步骤例1:拟将原料油中的有机硫通过催化加氢转变成H2S,进而脱出之,油中不饱和烃也加氢饱和。若原料油的进料速率为160m3/h,密度为0.9g/ml,氢气(标准状态)的进料速率为10800m3/h。原料油和产品油的摩尔分数组成如下。画出衡算系统方框图如下。写出反应方程式。原料油平均摩尔质量=188×0.05+156×0.7+154×0.25=157.1kg/kmol设脱硫后产品油的质量为R,对C物料衡算,则有:故,H2S的摩尔分数为44.91/281.4=0.16H2的摩尔分数为236.49/281.4=0.84例7-5P257物料名称气体膨胀率=N/100=159.21/100=1.5922.具有循环过程的物料衡算反应器例1:在银催化剂作用下,乙烯被空气氧化成环氧乙烷(C2H4O),副反应是乙烯完全氧化生成CO2和H2O。已知离开氧化反应器的气体干基组成是:C2H43.22%,N279.64%,O210.81%,C2H4O0.83%,CO25.5%(均为体积分数)。该气体进入水吸收塔,其中的环氧乙烷和水蒸气全部溶解于水中,而其他气体不溶于水,由吸收塔顶逸出后排放少量至系统外,其余全部循环回氧化反应器。计算(1)乙烯的单程转化率;(2)生成环氧乙烷的选择性;(3)循环比;(4)新鲜原料中乙烯和空气量之比。选取反应器出口气中100mol干气为衡算基准反应器围绕总系统做物料衡算。解四个方程得:X=2.008mol;Y=19.87mol;Z=1.085mol;W=19.55mol.副反应消耗的乙烯量=1.085/2=0.5425mol主反应消耗的乙烯量=生成的EO量=0.83mol乙烯的单程转化率=反应消耗的乙烯总量/进入反应器混合气中的乙烯量×100%=(0.83+0.5425)/(X+3.22-0.0325W)×100%=29.9%循环比=循环气量/排放气量=(99.19-W)/W=4.073(摩尔比或体积比)对于稳定的连续流动过程,无热量的积累,对于一个化学反应进行热量衡算热量衡算的基本步骤例甲烷在连续式反应器中空气氧化生产甲醛,副反应是甲烷完全氧化生成CO2和H2O。各组分单位进料(25℃)的焓值各组分单位出料的焓值(3)(5)物料当能量衡算不计动能变化时,例7-10p270