如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
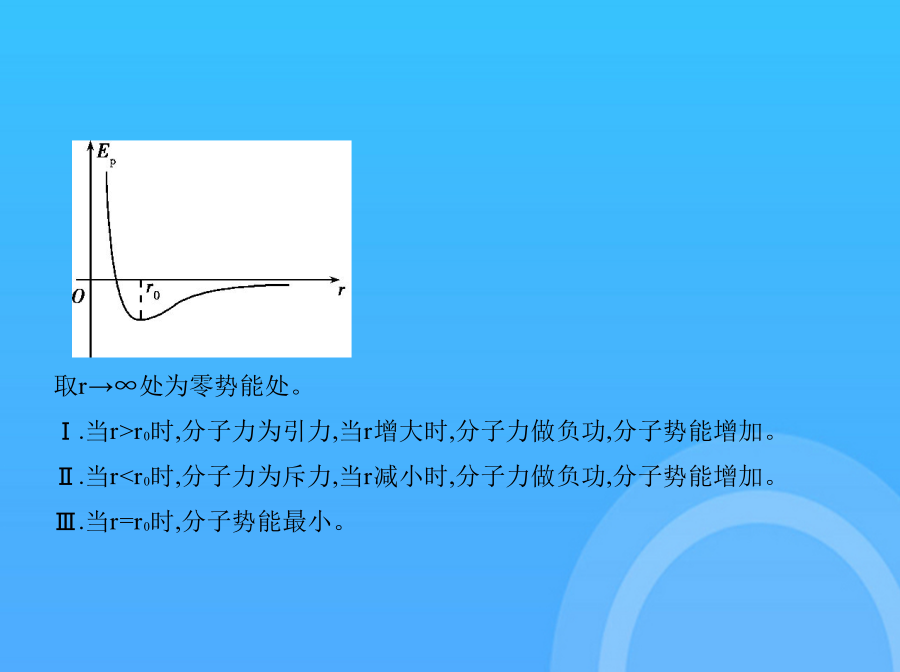
分子动理论内能知识梳理 一、物体是由大量分子组成的1.分子大小(1)分子的体积很小,它直径的数量级是①10-10m。(2)②油膜法可粗测分子直径。(3)分子大小计算有两种模型:一是③球体,二是④立方体,对气体分子用上述模型只能估算出⑤相邻两分子间平均距离。3.分子数量(1)阿伏加德罗常数:1mol的任何物质都含有相同的粒子数,这个数的测量值NA=⑦6.02×1023mol-1。(2)阿伏加德罗常数联系宏观和微观的公式NA= NA= (不适用于气体)(3)分子数量的计算N= 1.扩散现象是相互接触的物质彼此进入对方的现象,温度越高,扩散①越快。三、分子间的相互作用力3.引力和斥力都随分子间距离的增大而⑤减小,随分子间距离的减小而⑥增大,但斥力的变化比引力的变化⑦快。分子力随距离变化关系如图所示。 1.分子的平均动能(1)物体中所有分子动能的平均值叫做分子热运动的①平均动能。(2)温度是分子热运动的②平均动能的标志。2.分子势能(1)分子势能存在的原因由于分子间存在着相互③作用力,这样在分子之间就存在着由它们的相对位置所决定的④势能,称为分子势能。(2)分子势能的变化a.分子势能的变化和⑤分子力做功紧密联系在一起。分子力做正功,分子势能⑥减少;分子力做负功,分子势能⑦增加。b.分子力做的功与分子间相对位置的变化及分子间的作用力有关。c.分子势能与分子间距离的关系 取r→∞处为零势能处。Ⅰ.当r>r0时,分子力为引力,当r增大时,分子力做负功,分子势能增加。Ⅱ.当r<r0时,分子力为斥力,当r减小时,分子力做负功,分子势能增加。Ⅲ.当r=r0时,分子势能最小。3.物体的内能(1)定义:物体中所有分子做热运动的动能和分子势能的总和,叫做物体的⑧内能。(2)任何物体在任何情况下都具有内能。(3)⑨温度和⑩体积是影响内能的两个因素。 1.(多选)某气体的摩尔质量为M,摩尔体积为V,密度为ρ,每个分子的质量和体积分别为m和V0,则阿伏加德罗常数NA可表示为 ()A.NA= B.NA= C.NA= D.NA= 2.关于分子的热运动,以下叙述正确的是 ()A.布朗运动就是分子的热运动B.热运动是分子的无规则运动,同种物质的分子的热运动激烈程度相同C.气体分子的热运动不一定比液体分子激烈D.物体运动的速率越大,其内部的分子热运动就越激烈3.以下关于分子动理论的说法中不正确的是 ()A.物质是由大量分子组成的B.-2℃时水已经结为冰,部分水分子已经停止了热运动C.分子势能随分子间距离的增大,可能先减小后增大D.分子间的引力与斥力都随分子间距离的增大而减小深化拓展一、物体是由大量分子组成的(3)r<r0时,F引<F斥,分子力表现为④斥力。当r>r0时,随着r变大,F变小,Ep变小二氧化碳分子的质量和阿伏加德罗常数当r>r0时,随着r变大,F变小,Ep变大分子间同时存在着引力和斥力,实际表现出来的是分子引力和斥力的①合力。答案D当r>r0时,r变大,则分子力F先变大后变小,分子力做负功而分子势能变大,所以A、B选项错误;当r<r0时,r变小,则分子力F变大,分子力做负功,分子势能变大,所以C选项错误、D选项正确。设分子间距离为a,大气层中气体的体积为V,则有V=4πR2h,a= ,(1)该液化水中含有水分子的总数N;当r=r0时,分子势能最小。9×10-2kg/mol,阿伏加德罗常数NA=6.由于气体分子间隙很大,所以若用m表示一个油酸分子的质量,用V0表示一个油酸分子的体积,则下列表达式中正确的是 ()若用m表示一个油酸分子的质量,用V0表示一个油酸分子的体积,则下列表达式中正确的是 ()02×1023mol-1,是联系宏观世界和微观世界的桥梁。对液体、固体来说,微观模型是:分子紧密排列,将物质的摩尔体积分成NA等份,每一等份就是一个分子;在估算分子直径时,设想分子是一个一个紧挨的小球;在估算分子间距离时,设想每一个分子是一个正立方体,正立方体的边长即分子间距离。为ρ= ,V0= ,A、C、D错误,B正确。7×106m,月球表面重力加速度g=3.分子的两种理想模型(1)对于固体和液体,可以认为分子是一个个紧密排列在一起的球体,球体模型的体积V= πd3。(2)对于气体,由于分子间距离较大,可以利用立方体模型估算一个气体分子平均“占据”的空间,立方体模型的体积V=d3。(3)阿伏加德罗常数NA=6.02×1023mol-1,是联系宏观世界和微观世界的桥梁。【情景素材·教师备用】1-1(2019北京海淀零模,13)利用下列哪一组物理量可以算出二氧化碳的摩尔质量 ()A.二氧化碳的密度和阿伏加德罗常数B.二氧化碳分子的体积和二氧化碳的密