如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
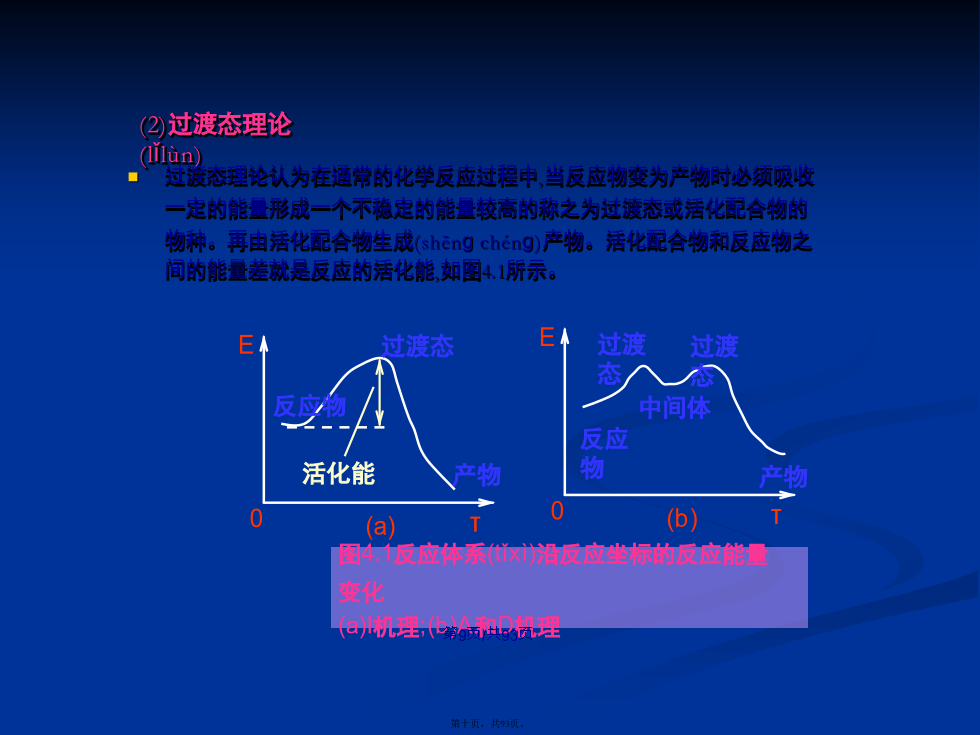
会计学4.1配体取代(qǔdài)反应如果取代反应发生的是金属离子间的取代称为亲电取代反应:MLn+M’→M’Ln+M一般地说,在配合物的取代反应中,较为常见的、也是本章所要讨论的是亲核取代反应。任何一个反应都必然涉及旧键的断裂和新键的生成(shēnɡchénɡ),然而这两个过程发生的时间可以不同。假设这一取代反应(fǎnyìng)可以通过下面几种方式进行:这种反应的机理(jīlǐ)叫做缔合机理(jīlǐ)(Association)或A机理(jīlǐ)。缔合机理(jīlǐ)的特点是:③与上述情况相反,如果配合物ML6首先解离出一个(yīɡè)配体L形成五配体的活性中间体ML5(一般认为它为四方锥构型,但也不排除三角双锥的可能性),而且这一步反应很慢,是决定反应的控制步骤。这种反应(fǎnyìng)机理叫做解离机理(Dissociation)或者D机理。④事实上,在大多数的取代反应中,进入配体的结合与离去配体的解离几乎是同时进行的,而且(érqiě)相互影响,这种机理称作交换机理(Interchange)或I机理。需要指出的是,在过去的文献中常用单分子亲核取代机理SN1(或称解离机理)和双分子亲核取代机理SN2(或称缔合机理)对取代反应(fǎnyìng)进行分类。(2)过渡态理论(lǐlùn)图4.1(a)表示一个具有I机理的取代反应能量变化曲线,反应物分子被活化(huóhuà)达到能量的最高点形成活化(huóhuà)配合物,这时分子中的各种键发生伸长或缩短,以利于反应物转变为产物。过渡态理论认为在反应物和活化配合(pèihé)物之间存在着一个热力学平衡,可以用下面的式子来表示:按照(ànzhào)过渡态理论,反应物通过活化位垒的速率常数为:另外,利用速率常数与压力(yālì)的关系:思考题?(3)活性取代配合(pèihé)物和惰性取代配合(pèihé)物不过,活性和惰性配合物之间并不存在明显的界限。因此,Taube建议(jiànyì):在298K时0.1mol·L-1溶液大约能在1min内完成反应的,可认为是活性配合物,大于1min的则是惰性配合物。例如,[Co(NH3)6]3+在动力学上是惰性的,室温时,它可以在酸性水溶液中存在(cúnzài)数日,然而,它在热力学上却是极不稳定的:过渡金属(jīnshǔ)配合物的取代活性或惰性与金属(jīnshǔ)的电子构型有关。因此,对于第一过渡系的金属离子(lízǐ),当具有d0、d1、d2以及d7、d8、d9构型时,生成的配合物应是活性的,d3以及d4~d6低自旋配合物是惰性的;而d4~d6的高自旋的配合物,在取代反应中仍显示出活性。2.八面体配合(pèihé)物的配体取代反应图4.2若干水合离子交换(lízǐjiāohuàn)反应的特征速率常数比较图4.2中的特征速率常数可以(kěyǐ)发现:图4.3M(H2O)62+离子水交换反应速率(sùlǜ)与d电子数的关系d轨道能级在几种配位场中的分裂状况示于图4.4(其中以八面体场的分裂能△0为单位)。对于不同d电子数的过渡金属水合离子,可以根据(gēnjù)图4.4分别计算出在强场或弱场中当它们的内界配位层由八面体转变为四方锥或五角双锥时LFSE的变化。表4.1解离(jiělí)机理(八面体→四方锥)和缔合机理(八面体→五角双锥)的LFAE(单位:△0)续表如果LFAE为负值,就表示由八面体转变到四方锥或五角双锥时,能量降低(jiàngdī),反应物容易变为活性中间体,换言之,即八面体配合物是动力学活性的。反之,若LFAE为正值,则是动力学惰性的。②d3、低自旋(zìxuán)的d4、d5、d6组态离子的八面体配合物,不管取代机理是按A机理或是按D机理进行,它们的LFAE均为正值,这些配合物均是惰性的,且取代速率按d5>d4>d3>d6依次变慢。d8组态离子,其八面体配合物无论是按D机理还是按A机理进行取代反应,LFAE均为正值,因而d8组态离子的八面体配合物是惰性的。d4(高自旋(zìxuán)),d9组态离子的八面体配合物,当按A机理进行取代反应时,LFAE为正值,属惰性配合物。由图4.3,M(H2O)62+的水交换反应(fǎnyìng)速率常数同d电子数的关系可见到具有d8构型的Ni(H2O)62+的取代反应(fǎnyìng)速率常数比具有d3构型的V(H2O)62+要大,但又比其他活性配合物的速率常数要小。这正说明了配位场理论的正确性。表4.2M3+的水交换(jiāohuàn)反应的活化参数从表列数据可知,Al3+和Ga3+的水交换反应的△H≠分别为112.9kJ﹒mol-1和26.3kJ·mol-1,这样大的差值意味着二者的水交换反应是经由(jīngyóu)不同的机理,即Al3+应当是解离机理,Ga3+为缔合机理。