如果您无法下载资料,请参考说明:
1、部分资料下载需要金币,请确保您的账户上有足够的金币
2、已购买过的文档,再次下载不重复扣费
3、资料包下载后请先用软件解压,在使用对应软件打开
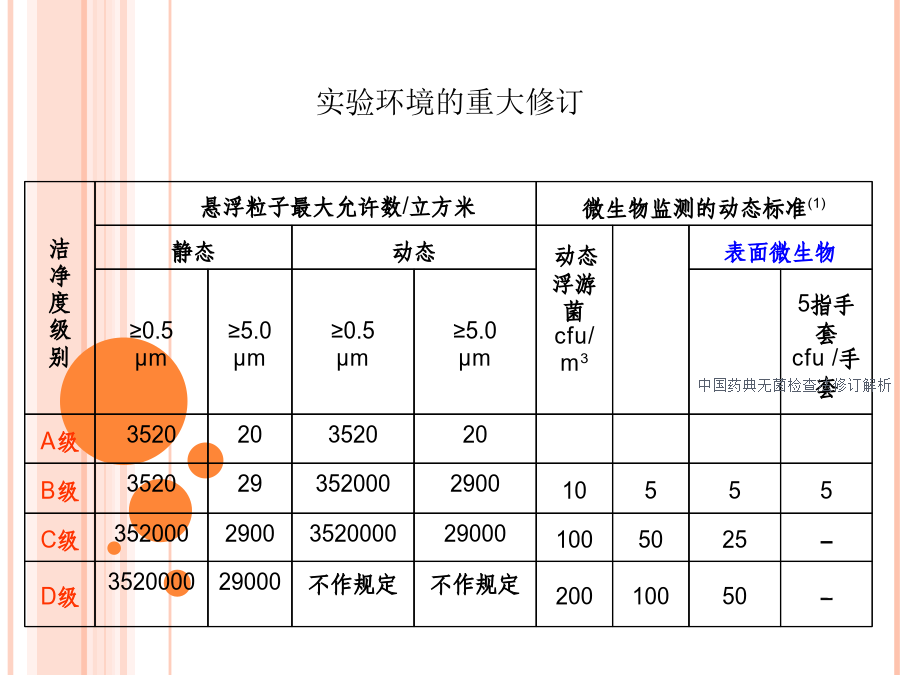
中国药典无菌检查法修订解析1、无菌是指某一物体或某一环境中不含有活的微生物。2、无菌检查法用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。3、无菌操作是指在无菌环境条件下,在对无菌制品或无菌器械等进行检验的过程中,能防止微生物污染与干扰的一种常规操作方法。4、无菌技术是指在微生物试验工作中,控制或防止各类微生物的污染及其干扰的一系列操作方法和有关措施,其中包括无菌环境设施、无菌试验器材及无菌操作。5、无菌检查法的局限性若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。也就是无菌试验并不能用于保证整批产品的无菌性,但是它可用于确定批产品不符合无菌要求。灭菌产品的无菌保证不能依赖于最终产品的无菌检验,它是作为确定批无菌产品是否无菌的一个检验项目,而产品的无菌保证要取决于生产过程中采用合格的灭菌工艺、良好的无菌保证体系和严格的GMP管理。1.理论上的局限性2.统计概率的局限性3.检验条件的局限性主要内容我国药典无菌检查法与欧美药典的差异2015版药典无菌检查法的增、修订内容-2010年版无菌检查应在洁净度10000级背景下的局部100级单向流空气区域内或隔离系统进行2015年版无菌检查在无菌条件下进行试验,环境必须达到无菌检查的要求。2010年版1.硫乙醇酸盐流体培养基30~35℃;20~25℃2.改良马丁培养基23~28℃培养。3.选择性培养基4.0.5%葡萄糖肉汤培养基5.营养肉汤培养基6.营养琼脂培养基7.改良马丁琼脂培养基2015年版1.硫乙醇酸盐流体培养基30~35℃;20~25℃培养2.胰酪大豆胨肉汤培养基20~25℃培养。3.选择性培养基4.0.5%葡萄糖肉汤培养基5.胰酪大豆胨琼脂培养基6.沙氏葡萄糖肉汤培养基7.沙氏葡萄糖琼脂培养基硫乙醇酸盐流体培养基厌氧菌检查(首选)需气菌检查。胰酪大豆胨液体培养基真菌和需气菌的检查。培养基灵敏度检查实验菌株的修订菌液制备用培养基2010版硫乙醇酸盐流体培养基接入小于100cfu的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、生孢梭菌改良马丁培养基接入小于100cfu的白色念珠菌、黑曲霉。2015版硫乙醇酸盐流体培养基接入小于100CFU的金黄色葡萄球菌、大肠埃希菌、生孢梭菌各2管胰酪大豆胨液体培养基接入小于100CFU的枯草芽孢杆菌、白色念珠菌、黑曲霉。ICHQ6B,USP、EP、BP、JP无菌检查法中生物技术产品/及生物制品检定规程、标准没有对生物制品作出特殊的规定。整合中的焦点:培养温度三部无菌检查法规定样品接种硫乙醇酸盐流体培养基必须分成双份,分别置30~35℃、20~25℃两个温度下培养。以致在取样量、检验量、接种方式、培养温度、阳性对照试验等方面存在与二部不一致的规定。修订原则:以国际发展趋势为主导,遵照2015年版药典编制大纲的要求进行,以二部为基础,整合稿保留了生物制品无菌检查法的特点,在检验数量、检验量、阳性对照、培养温度方面互相兼顾,作原则性要求而不作具体细则规定。致力于逐步修订完善。检验数量的整合检验量的整合参照USP对表1、表2、表3整合修订内容阳性对照试验按原二部的规定:⒈供试品用量同供试品无菌检查每份培养基接种的样品量。⒉阳性对照试验的菌液制备同方法适用性试验,加菌量小于100CFU。⒊阳性对照管培养48~72小时应生长良好。阴性对照试验阴性对照试验按原二部的规定:取相应溶剂和稀释液、冲洗液同法操作,作为阴性对照。阴性对照不得有菌生长。薄膜过滤法直接接种法培养及观察整合结果判断整合按原二部的规定2015版无菌检查法增、修订内容说明2010版金葡、大肠、枯草、生孢白色、黑曲2015版金葡、大肠、生孢枯草、白色、黑曲⒈医院制剂当前面临的形势⒉医院制剂微生物检查重点⒊个例医院制剂微生物检查重点妇科、儿科及风险高、质量可控不强的冲洗剂、眼用制剂及用于烧伤、创伤等需要进行无菌检查严格的制定质量标准。微生物检查应对其方法可行性,可靠性进行验证(适用性检查),以保证检验方法的科学性,检验结果的准确性。⒈国家规定滴眼液应进行无菌检查①2010版《中国药典》制剂通则规定眼用制剂照无菌检查法检查,应符合规定。②国家局(2010)43号文“关于实施《中国药典》2010年版有关事宜的公告”-五、中国药典关于眼用制剂无菌要求的具体执行时间将根据《药品生产质量管理规范》实施的要求另行规定。③国家局(2012)106号文,眼内注射液,眼内插入剂,供手术、伤口、角膜穿透伤用的眼用制剂以及眼用液体制剂应在2013年12月31日前达到新修订药品GMP要求,其它眼用制